Οργανική Χημεία/Θεμελιώδεις έννοιες της Οργανικής Χημείας
Ιστορία της Οργανικής Χημείας
[επεξεργασία]Σύντομο Ιστορικό
[επεξεργασία]Ο Τζονς Τζάκομπ Μπερζέλιους (Jöns Jacob Berzelius) ένας γιατρός εισήγαγε τον όρο Οργανική Χημεία το 1807 για τη μελέτη των χημικών ενώσεων που προέρχονται από βιολογικές πηγές. Μέχρι και τις αρχές του 19ου αιώνα οι φυσιοδύφες και οι επιστήμονες παρατήρησαν ορισμένες κρίσιμες διαφορές μεταξύ των χημικών ενώσεων που προέρχονται από ζώντες οργανισμούς και αυτών που δεν προέρχονται.
Οι χημικοί της περιόδου σημείωσαν ότι φαινόταν να υπάρχουν ουσιαστικές αλλά ανεξήγητες (για την εποχή) διαφορές μεταξύ των ιδιοτήτων των δυο αυτών κατηγοριώμ χημικών ενώσεων. Γι' αυτό διατυπώθηκε και έγινε ευρύτατα αποδεκτή η θεωρία της ζωτικής δύναμης (vis vitalis), σύμφωνα με την οποία υπάρχει μια άγνωστη προέλευσης δύναμη στις οργανικές ενώσεις αλλά όχι στις ανόργανες και η οποία εξηγούσε τις διαφορές στις ιδιότητες και εμπόδιζε την παραγωγή οργανικών ενώσεων από μη οργανικές, παρά μόνο μέσα σε ζωντανούς οργανισμούς.
Η σύνθεση της ουρίας
[επεξεργασία]
Ο Φριέντριχ Βόχλερ (Friedrich Wöhler) θεωρείται ευρύτατα ως ένας πρωτοπόρος της οργανικής χημείας, αφού με την εργαστηριακή σύνθεση της ουρίας που πραγματοποίησε διέψευσε τη μυθώδη θεωρία της ζωτικής δύναμης. Η διεργασία που ακολούθησε ονομάζεται σύνθεση Wöhler. Συγκεκριμένα ανάμειξε κυανικό άργυρο (AgCNO) ή κυανικό μόλυβδο (Pb(CNO)2) με νιτρικό αμμώνιο (NH4NO3) περιμένοντας να έχει μια χημική αντίδραση διπλής αντικατάστασης και να πάρει κυανικό αμμώνιο (NH4CNO) και νιτρικό άργυρο (AgNO3) ή νιτρικό μόλυβδο (Pb(NO3)2), αντίστοιχα. Πρόσεξε όμως ότι το τελικό προϊόν της σύνθεσης δεν ήταν το ανόργανο άλας κυανικό αμμώνιο, αλλά η οργανική ένωση ουρία ((NH2)2CO), δηλαδή ένα βιολογικό προϊόν! Αυτό συμβαίνει γιατί το αρχικά παραγόμενο κυανικό αμμώνιο ισομεριώνεται (δείτε παρακάτω την έννοια του όρου), όταν θερμαίνεται, σε ουρία. Μέχρι αυτήν την ανακάλυψη, το 1828, οι χημικοί πίστευαν, βάσει της θεωρίας ζωτικής δύναμης, ότι οι οργανικές ενώσεις παράγονται μόνο από ζωντανούς οργανισμούς με τη χρήση της μυστυριώδους ζωτικής δύναμης, που πίστευαν ότι υπήρχε. Η σύνθεση του Wöhler κατέδειξε δραματικά πως αυτή η θεωρία είναι εσφαλμένη. Η σύνθεση της ουρίας ήταν μια κρίσιμη ανακάλυψη για τους βιοχημικούς γιατί έδειξε ότι μια ένωση που είναι γνωστό ότι παράγεται στη φύση από ζωντανούς οργανισμούς είναι δυνατό να παραχθεί και σε ένα χημικό εργαστήριο, κάτω από ελεγχόμενες συνθήκες, από ανόργανη ύλη. Αυτή η in vitro σύνθεση οργανικής ύλης κατέρρηψε την θεωρία ζωτικής δύναμης και την εμμονή ότι χρειάζεται η μεσολάβηση ζωντανού οργανισμού για την παραγωγή οργανικών ενώσεων.
Ανόργανη και Οργανική Χημεία
[επεξεργασία]Παρόλο που η Οργανική Χημεία αρχικά είχε οριστεί ως η Χημεία των βιολογικής προέλευσης χημικών ενώσεων, ο ορισμός της έχει ξαναοριστεί ως η Χημεία των ενώσεων του άνθρακα εκτός από μια σειρά εξαιρέσεων, δηλαδή χημικών ενώσεων του άνθρακα που όμως κατατάσσονται στις ανόργανες. Συγκεκριμένα, οι ανόργανες ενώσεις του άνθρακα είναι κυρίως οι ακόλουθες: το μονοξείδιο του άνθρακα (CO), το διοξείδιο του άνθρακα (CO2), το ανθρακικό οξύ (H2CO3), τα ανθρακικά άλατα, τα όξινα ανθρακικά άλατα, τα καρβίδια μετάλλων, το υδροκυάνιο (HCN), τα κυανιούχα άλατα, το δικυάνιο ((CN)2), το υδροκυανικό οξύ (HCNO), τα κυανικά άλατα, το υδροθειοκυάνιο (HSCN), τα θειοκυανιούχα άλατα και οι σύμπλοκες ενώσεις που περιέχουν ως ανθρακούχους συναρμωτές μόνο CO, CN, CNO ή SCN.
Η Οργανική Χημεία επικεντρώνεται στον άνθρακα και παρακολουθεί τις μετακινήσεις της εξωτερικής στοιβάδας των ηλεκτρονίων του κάθε ατόμου του, καθώς σχηματίζει αλυσίδες και δακτυλίους με άλλα άτομα άνθρακα ή και άλλων χημικών στοιχείων, που συχνά αποκαλούνται ετεροάτομα. Η Οργανική Χημεία πρώτιστα ενδιαφέρεται με τις ιδιότητες των ομοιομεταλλικών δεσμών μεταξύ αμετάλλων στοιχείων, αν και ιόντα, μέταλλα και μεταλλοειδή μπορεί να έχουν κρίσιμο ρόλο σε κάποιες οργανικές αντιδράσεις.
Οι εφαρμογές της Οργανικής Χημείας αριθμούν πολλά εκατομμύρια ενώσεις που περιλαμβάνουν σχεδόν όλα τα είδη πλαστικών, βερνικιών, αρωμάτων, απορρυπαντικών, εκρηκτικών, καυσίμων, φαρμάκων και πλήθος άλλων προϊόντων. Διαβάζοντας τις ετικέτες συστατικών των περισσοτέρων τροφίμων και άλλων καθημερινής χρήσης προϊόντων θα δείτε μεγάλο ποσοστό οργανικών ενώσεων ή και ομάδων αυτών που περιλαμβάνονται στις σχετικές λίστες.
Ορόσημα της προόδου της Οργανικής Χημείας
[επεξεργασία]Φυσικά κάθε κείμενο που περιλαμβάνει την Ιστορία της Χημείας (γενικότερα) θα πρέπει τουλάχιστον να αναφέρει το Γάλλο χημικό Αντοΐν Λαυρέντ Λαβοϊζιέ (Antoine Laurent Lavoisier), που συχνά αποκαλείται ως "πατέρας της σύγχρονης χημείας" και έχει εξασφαλήσει την πρώτη θέση στο "πάνθεον" των μεγάλων μορφών της Χημείας. Η συνεισφορά του δεν θα επαναληφθεί σ' αυτό το κείμενο, καθώς κάτι τέτοιο θα κατανάλωνε πολύ χώρο σ' αυτήν τη σχετικά σύντομη εισαγωγή.
Ο Μπερζέλιους και ο Βόχλερ αναφέρθηκαν παραπάνω, ως ιδρυτές ουσιατικά του ειδικού πεδίου της Οργανικής Χημείας. Μετά από αυτούς τους τρεις, υπάρχουν τρεις επιπλέον χημικοί με ιδιαίτερα επιφανή συνεισφορά στον τομέα της Οργανικής Χημείας και ιδιαίτερα στην εξερεύνηση της δομής των οργανικών χημικών ενώσεων. Πρόκειται για τους α) Αυγκούστ Κεκουλέ (August Kekulé), β) Άρτσιμπαλντ Κούπερ και γ) Αλεξάντερ Μπουτλέροβ (Alexander Butlerov).
Ο Κεκουλέ ήταν ένας Γερμανός αρχιτέκτονας (ως προς τις σπουδές) που ήταν ίσως ο πρώτος που πρότεινε την ικανότητα του άνθρακα να σχηματίζει ισομερείς ενώσεις, εξαιτίας της μεγάλης ευελιξίας που του δείνει η δυνατότητα του κάθε ατόμου του να σχηματίζει τέσσερεις σταθερούς δεσμούς με όμοια και ανόμοια άτομα. Αυτή η ικανότητα είναι ιδανική για το σχηματισμό ποικίλων συνδυασμών ακόμη και μακρών αλυσίδων και δακτυλίων, με απλούς, διπλούς και τριπλούς δεσμούς. Αυτό δείνει συχνά τη δυνατότητα σχηματισμού μεγάλης ποικιλίας τρόπων σύνδεσης που καταλήγουν σε διαφορετικές χημικές ενώσεις με διαφοροποιημένες φυσικές και χημικές ιδιότητες. Ο Κούπερ ήταν ένας Σκωτσέζος χημικός και ο Μπουτλέροβ ένας Ρώσος χημικός, που κατέλειξαν σε παρόμοια συμπεράσματα σχεδόν ταυτόχρονα μεταξύ τους.
Ανάμεσα στο 19ο και στον 20ό αιώνα τα πειραματικά αποτελέσματα έφεραν στο φως πολλές νέες γνώσεις για τα άτομα, τα μόρια και τους μοριακούς δεσμούς. Το 1828 ο Γκίλμπερτ Λιούις (Gilbert Lewis) περιέγραψε τον ομοιοπολικό δεσμό, όπως τον ξέρουμε ευρύτατα σήμερα, δηλαδή ως συνεισφορά ηλεκτρονίων μεταξύ ατόμων. Ο Λίνους Πάουλινγκ (Linus Pauling) προχώρησε ακόμη παραπέρα τα συμπεράσματα του Λιούις. Την ίδια εποχή, ο Σερ Ρόμπερτ Ρόμπινσον (Sir Robert Robinson) εστίασε κυρίως στα ηλεκτρόνια των ατόμων και τα παρομοίασε με μηχανές των μοριακών μεταβολών. Ο Σερ Κρίστοφερ Ίνγκολντ (Sir Christopher Ingold) οργάνωσε την κατάταξη των οργανικών αντιδράσεων με βάση τους γνωστούς σήμερα μηχανισμούς, σε μια προσπάθεια να γίνουν καλύτερα κατανοητές ως μια ακολουθία αλλαγών στη σύνθεση που συμπεριλαμβάνονται σε κάθε συνολική αντίδραση.
Το πεδίο της Οργανικής Χημείας είναι πιθανότατα το πιο ενεργό και σημαντικό πεδίο της χημείας, επί το παρόντος τουλάχιστον, εξαιτίας των εξαιρετικών εφαρμογών της τόσο στη Βιοχημεία (ιδιαίτερα στη Φαρμακευτική Χημεία) αλλά και στην Πετροχημεία (ιδιαίτερα στην Ενεργειακή Χημεία). Η Οργανική Χημεία έχει μια σχετικά πρόσφατη ιστορία, αλλά φαίνεται να έχει μπροστά ένα τεράστιας σημασίας μέλλον που μάλλον θα επιρεάσει τις ζωές των ανθρώπων αυτού του πλανήτη για πάρα πολλά χρόνια ακόμη, χωρίς ορατό τέλος.
Ατομική δομή
[επεξεργασία]
Τα άτομα αποτελούνται από έναν πυρήνα και ένα ή περισσότερα ηλεκτρόνια που περιφέρονται γύρω του. Ο πυρήνας του ατόμου αποτελείται από ένα ή περισσότερα πρωτόνια και από μηδέν ή περισσότερα νετρόνια. Ένα άτομο, στη φυσική του κατάσταση είναι ηλεκτρικά ουδέτερο και περιέχει πάντα ίσο αριθμό ηλεκτρονίων και πρωτονίων που ονομάζεται ατομικός αριθμός και είναι χαρακτηριστικός για κάθε χημικό στοιχείο.
Ο πυρήνας αποτελείται από πρωτόνια, που είναι θετικά φορτισμένα, και συνήθως νετρόνια, που δεν έχουν ηλεκτρικό φορτίο. Τα πρωτόνια και τα νετρόνια έχουν την ίδια περίπου μάζα και όλα μαζί έχουν το σύνολο σχεδόν της ατομικής μάζας.
Τα ηλεκτρόνια είναι αρνητικά φορτισμένα σωματίδια. Το ηλεκτρικό φορτίο κάθε ηλεκτρονίου είναι ίσο κατ' απόλυτη τιμή με αυτό ενός πρωτονίου, αλλά η μάζα του ηλεκτρονίου είναι περίπου 2.000 φορές μικρότερη από αυτήν του πρωτονιου. Τα ηλεκτρόνια περιφέρονται γύρω από τον πυρήνα του ατόμου, αλλά τόσο γρήγορα ώστε είναι αδύνατο να καθοριστεί πού βρίσκονται σε μια δεδομένη χρονική στιγμή. Η εικόνα αντιπροσωπεύει το παλιό ατομικό πρότυπο του Bohr. σύμφωνα με το οποίο τα ηλεκτρόνια περιφέρονται σε διακριτές στοιβάδες γύρω από τον πυρήνα, περίπου όπως οι πλανήτες περιφέρονται γύρω απο τον Ήλιο. Αυτό το απλοποιημένο μοντέλο θεωρείται πια παρωχημένο. Τα υφιστάμενα μοντέλα ατομικής δομής θεωρούν ότι τα ηλεκτρόνια βρίσκονται σε ηλεκρονικά νέφη συγκεκριμένων σχημάτων γύρω από τον πυρήνα. Μερικά από τα ηλεκτρονικά νέφη είναι σφαιρικά, ενώ άλλα έχουν πιο πολύπλοκα σχήματα.
Τα ηλεκτρόνια περιφέρονται γύρω από τον πυρήνα του ατόμου σε ηλεκρονικά νέφη διακριτών σχημάτων και μεγεθών. Τα ηλεκτρονικά νέφη βρίσκονται το ένα μέσα στο άλλο κατά ομάδες που ονομάζονται στοιβάδες. Κάθε ηλεκτρόνιο που βρίσκεται στο απλούστερο τροχιακό μέσα στη στοιβάδα που αντιστοιχεί στη χαμηλότερη ενεργειακή στάθμη, ενώ καθένα από αυτά που βρίσκονται στα πιο πολύπλοκα τροχιακά βρίσκονται μέσα στη στοιβάδα που αντιστοιχεί στην υψηλότερη ενεργειακή στάθμη. Σε όσο υψηλότερη ενεργειακή στάθμη βρίσκεται ένα ηλεκτρόνιο, τόσο υψηλότερη ενέργεια έχει, όπως μια πέτρα που βρίσκεται στην κορυφή ενός λόφου έχει υψηλότερη (δυναμική) ενέργεια απ' όσο μια όμοια πέτρα κάτω στην κοιλάδα. Ο κύριος λόγος γιατί κάποια ηλεκτρόνια βρίσκονται στα υψηλότερης ενέργειας τροχιακά είναι ότι δυο ηλεκτρόνια δεν μπορούν να βρίσκονται στο ίδιο τροχιακό. Έτσι, τα ηλεκτρόνια καταλαμβάνουν θέσεις στα χαμηλότερης ενέργειας τροχιακά που είναι διαθέσιμα. Ένα ηλεκτρόνιο είναι δυνατό όμως να ωθηθεί σε ένα υψηλότερης ενέργειας τροχιακό, αν απορροφήσει ενέργεια από κάποιο φωτόνιο. Αυτή όμως η κατάσταση δεν είναι σταθερή και γι' αυτό είναι πρόσκαιρη. Σύντομα το ηλεκτρόνιο επανέρχεται στο χαμηλότερης ενέργειας τροχιακό που είναι διαθέσιμο, επανεκπέμποντας το φωτόνιο. Αυτοί οι κανόνες είναι σημαντικό να γίνουν κατανοητοί για να γίνουν με τη σειρά τους κατανοητά φαινόμενα που έχουν να κάνουν με την οπτική ενεργότητα των χημικών ενώσεων, που θα περιγραφούν παρακάτω, αλλά και φαινόμενα εκτός του πεδίου της Οργανικής Χημείας, όπως π.χ. οι ακτίνες laser.
Κβαντομηχανική περιγραφή του ατόμου
[επεξεργασία]Κάθε διαφορετική στοιβάδα υποδιαιρείται σε ένα ή περισσότερα διακριτά τροχιακά, που επίσης αντιστοιχούν σε διακριτά ενεργειακά επίπεδα, αν και οι ενεργειακές διαφορές μεταξύ των τροχιακών είναι μικρότερες από τις ενεργειακές διαφορές μεταξύ των στοιβάδων. Ακτινοβολίες με μεγαλύτερα μήκη κύματος έχουν μικρότερη ενέργεια. Το τροχιακό s έχει το μεγαλύτερο μήκος υλοκύματος και επιτρέπει σε ένα ηλεκτρόνιο που περιφέρεται γύρω από τον πυρήνα σε αυτό το τροχιακό να κατέχει το χαμηλότερο και πιο σταθερό ενεργειακό επίπεδο.
Κάθε τροχιακό έχει ένα χαρακτηριστικό σχήμα που δείχνει πού βρίσκεται το ηλεκτρόνιο πιο συχνά. Τα τροχιακά ονομάζονται με τη χρήση πεζών γραμμάτων της αγγλικής αλφαβήτου. Κατά αύξουσα ενέργεια τα τροχιακά που χρησιμοποιούνται στα άτομα των γνωστών χημικών στοιχείων είναι: s, p, d και f.
Οι ηλεκτρονικές στοιβάδες αντιπροσωπεύονται από τον κύριο κβαντικό αριθμό n. Καθώς αυξάνεται ο n της στοιβάδας αυξάνεται και ο αριθμός των διαθέσιμων τροχιακών ανά στοιβάδα. Π.χ. το 3s τροχιακό αναφέρεται στο s τροχιακό της στοιβάδας #2.

Τα s τροχιακά είναι τα τροχιακά που αντιστοιχούν στι μικρότερο επίπεδο ενέργειας ανά στοιβάδα και έχουν σφαιρικό σχήμα. Τα ηλεκτρόνια σε αυτά τα τροχιακά βρίσκονται στη στοιχειώδη τους συχνότητα. Αυτά τα τροχιακά μπορούν να κατέχουν το πολύ μέχρι και δύο ηλεκτρόνια, που διαφέρουν μόνο ως προς το πρόσημο του αριθμού spin.

Υπάρχουν τρία διαφορετικά τροχιακά p ανά στοιβάδα, που έχουν το ίδιο ενεργειακό επίπεδο και διαφέρουν ως προς τη διάταξη στο χώρο και τη συμπεριφορά μέσα σε ισχυρό μαγνητικό πεδίο. Τα τρία p τροχιακά αναφέρονται ως px, py και pz. Τα s και p τροχιακά είναι τα σημαντικότερα για την Οργανική Χημεία, γιατί είναι αυτά που καταλαμβάνονται στα άτομα των χημικών στοιχείων που είναι τα πιο συνηθισμένα στις οργανικές ενώσεις.

Υπάρχουν πέντε διαφορετικά τροχιακά d ανά στοιβάδα, που έχουν το ίδιο ενεργειακό επίπεδο και διαφέρουν ως προς τη διάταξη στο χώρο και τη συμπεριφορά μέσα σε ισχυρό μαγνητικό πεδίο. Τα d τροχιακά χρησιμοποιούνται μεταξύ άλλων από τα στοιχεία πυρίτιο, θείο, φωσφόρο, σελήνιο και αρσενικό, που μετέχουν αρκετά συχνά σε οργανικές ενώσεις.

Υπάρχουν επτά διαφορετικά τροχιακά f ανά στοιβάδα, που έχουν το ίδιο ενεργειακό επίπεδο και διαφέρουν ως προς τη διάταξη στο χώρο και τη συμπεριφορά μέσα σε ισχυρό μαγνητικό πεδίο. Τα f τροχιακά χρησιμοποιούνται από τα στοιχεία που σπάνια μετέχουν σε οργανικές ενώσεις.
Κανόνες συμπλήρωσης ηλεκτρονικών στοιβάδων
[επεξεργασία]Όταν ένα άτομο ή ιόν λάμβάνει ηλεκτρόνια στα τροχιακά του, τα τροχιακά και οι στοιβάδες του γεμίζουν με ένα συγκεκριμένο τρόπο.
Υπάρχουν τρεις αρχές που διέπουν αυτή τη διαδικασία:
- Η απαγορευτική αρχή του Pauli.
- Η αρχή του Aufbau.
- Ο κανόνας του Hund.
Η απαγορευτική αρχή του Pauli
[επεξεργασία]Σύμφωνα με την απαγορευτική αρχή του Pauli σε ένα άτομο ή ιόν δεν μπορούν να υπάρχουν δυο ηλεκτρόνια με την ίδια τετράδα κβαντικών αριθμών. Αυτό σημαίνει ότι κάθε τροχιακό μπορεί να έχει μέχρι και δυο ηλεκτρόνια που διαφέρουν στο πρόσημο του τέταρτου κβαντικού αριθμού που είναι το spin.
Ο κανόνας του Hund
[επεξεργασία]Οι ενεργειακές καταστάσεις που αντιστοιχούν σε πλήρεις ή ημιπλήρεις στοιβάδες τείνουν να έχουν επιπρόσθετη σταθερότητα. Για παράδειγμα, τα τροχιακά 4s συμπληρώνονται πριν συμπληρωθούν τα τροχιακά 3d. Ειδικά στην Οργανική Χημεία, αυτή η αρχή έχει επιπτώσεις μόνο στο τμήμα της Οργανομεταλλικής Χημείας με μέταλλα μετάπτωσης.
Ο κανόνας της οκτάδας
[επεξεργασία]Ο κανόνας της οκτάδας δηλώνει ότι τα άτομα τείνουν να προτιμούν να έχουν οκτώ ηλεκτρόνια στην εξωτερική τους στοιβάδα και γι' αυτό τείνουν να συνδυαστούν με τέτοιον τρόπο ώστε να την αποκτήσουν, αποβάλλοντας, λαμβάνοντας ή συνεισφέροντας ηλεκτρόνια με άλλα διπλανά, ώστε να αποκτήσουν τη σταθερή δομή των ευγενών αερίων που αντιστοιχεί στα οκτώ ηλεκτρόνια στην εξωτερική στοιβάδα.
Μια εξαίρεση στον παραπάνω κανόνα αποτελεί το ευγενές αέριο ήλιο, που έχει σταθερή δομή ευγενούς αερίου με δύο μόνο ηλεκτρόνια στην πρώτη στοιβάδα, αφού αυτή έτσι κι αλλιώς δεν μπορεί να έχει περισσότερα, αφού διαθέτει μόνο το 1s τροχιακό. Ομοίως, τα στοιχεία υδρογόνο, λίθιο και βηρύλλιο τείνουν να αποκτήσουν τη δομή του ηλίου.
Άλλες αξιοσημείωτες εξαιρέσεις αποτελούν το αλουμίνιο και το βόριο που λειτουργούν καλά και με έξι ηλεκτρόνια στην εξωτερική τους στοιβάδα. Υπάρχουν ακόμη μερικά στοιχεία που βρίσκονται πάνω από την τρίτη περίοδο του περιοδικού συστήματος που μπορούν να έχουν πάνω από οκτώ ηλεκτρόνια στην εξωτερική τους στοιβάδα, όπως π.χ. το θείο. Ακόμη, κάποια ευγενή αέρια σχηματίζουν ενώσεις όταν επεκτείνουν την εξωτερική τους στοιβάδα.
Μοριακά τροχιακά και χημικός δεσμός
[επεξεργασία]Ο υβριδισμός των τροχιακών
[επεξεργασία]Ο υβριδισμός αναφέρεται σε συνδυασμό τροχιακών από δύο ή περισσοτέρων ομοιοπολικά ενωμένων ατόμων. Εξαρτάται από τον αριθμό των ελεύθερων ηλεκτρονίων που διαθέτει ένα άτομο και πόσους δεσμούς σχηματίζει, συνήθως τροχιακά s και p (μερικές φορές και d) συνδυάζονται με διάφορους τρόπους για να σχηματίσουν δεσμούς.
Είναι αρκετά εύκολο να καθορίσει κανείς τον υβριδισμό που έχει ένα άτομο από τη δομή του κατά Lewis. Πρώτα μετρά κανείς τα ζευγάρια ελεύθερων ηλεκτρονίων και τον αριθμό των σ δεσμών (δηλαδή των απλών δεσμών). Τυχόν διπλοί και τριπλοί δεσμοί περιέχουν π δεσμούς που δεν πρέπει να προσμετρηθούν. Όταν το υπολογιστεί και το άθροισμα των δυο παραπάνω αριθμών (αριθμός μονήρων ζευγών + αριθμός σ δεσμών) ο υβριδισμός βρίσκεται σύμφωνα με τον ακόλουθο πίνακα:
σ δεσμοί + Μονήρη ζεύγη Υβριδισμός
2 sp
3 sp2
4 sp3
5 sp3d ή sp2d2
6 sp3d2
7 sp3d3
8 sp3d4
Η δομές που προκύπτουν για κάθε υβριδισμό είναι:
sp: Ευθύγραμμη.
sp2: Τριγωνική.
sp3: Τετραεδρική.
sp3d: Τετραγωνική πυραμιδική.
sp2d2: Τριγωνική διπυραμιδική.
sp3d2: Οκταεδρική.
sp3d3: Πενταγωνική διπυραμιδική.
sp3d4: Κυβική.
Διπλός και τριπλός δεσμός
[επεξεργασία]Αποκλίσεις από την τετρασθένεια του άνθρακα
[επεξεργασία]Ηλεκτραρνητικότητα
[επεξεργασία]Όποτε δυο άτομα σχηματίζουν ένα δεσμό ο πυρήνας του καθενός έλκει και τα ηλεκτρόνια του άλλου. Η ηλεκτραρνητικότητα είναι ένα μέτρο της ισχύος αυτής της έλξης.
Περιοδικές τάσεις
[επεξεργασία]Διάφορες ομάδες χημικών στοιχείων λέγεται ότι έχουν περιοδικές τάσεις, δηλαδή διαφορετικά χημικά στοιχεία στην ίδια περίοδο του περιοδικού πίνακα έχουν ταυτοποιήσιμες σχέσεις μεταξύ τους που βασίζονται στη θέση τους στο περιοδικό σύστημα.
Το μέγεθος των ατόμων είναι ένα χαρακτηριστικό που δείχνει περιοδικές τάσεις. Το μέγεθος αυτό μετριεται με βάση την ατομική ακτίνα του κάθε στοιχείου. Σε μια περίοδο, π.χ. τη δεύτερη, η ατομική ακτίνα μειώνεται από τα αριστερά στα δεξιά του περιοδικού συστήματος. Δηλαδή:
Li > Be > B > C > N > O > F > Ne
Ένα άλλο χαρακτηριστικό που δείχνει περιοδικές τάσεις είναι η ενέργεια ιονισμού, δηλαδή η ενέργεια που απαιτεί ένα άτομο για να αποβάλλει ένα ηλεκτρόνιό του. Σε μια περίοδο, π.χ. τη δεύτερη, η ενέργεια ιονισμού αυξάνεται από τα αριστερά στα δεξιά του περιοδικού συστήματος. Δηλαδή:
Li < Be < B < C < N < O < F < Ne
Η ηλεκτραρνητικότητα είναι πιθανότατα το πιο σημαντικό χαρακτηριστικό με περιοδικές τάσεις, αν και δεν είναι ευθέως σχετική με την ενέργεια ιονισμού, αλλά η τάση του είναι η ίδια, δηλαδή αυξάνεται από τα αριστερά στα δεξιά του περιοδικού συστήματος. Δηλαδή στη δεύτερη περίοδο:΄
Li < Be < B < C < N < O < F
Επίσης, στην ίδια ομάδα του περιοδικού συστήματος, π.χ. στα αλογόνα, δηλαδή στην VIIA, η ηλεκτραρνητικότητα μειώνεται από πάνω προς τα κάτω του περιοδικού συστήματος. Δηλαδή:
F > Cl > Br > I > At
- Σημειώστε ότι το ευγενές αέριο νέον δεν περιλαμβάνεται στην παραπάνω κατάταξη ηλεκτραρνητικότητας. Στη μη ιονισμένη μορφή του τα ευγενή αέρια συνήθως θεωρούνται ότι δεν έχουν καθόλου ηλεκτραρνητικότητα.
Ηλεκτροαρνητικότητες κατά Pauling για τα πιο συνηθισμένα στοιχεία στην Οργανική Χημεία
[επεξεργασία]- C: 2,55
- H: 2,20
- F: 3,98
- Cl: 3,16
- Br: 2,96
- I: 2,66
- O: 3,44
- S: 2,58
- Se: 2,55
- Te: 2,10
- N: 3,04
- P: 2,19
- As: 2,18
- Sb: 2,05
- Bi: 2,02
- Si: 1,90
- Ge: 2,01
- Sn: 1,96
- Pb: 2,33
- B: 2,04
- Be: 1,57
- Mg: 1,31
- Ca: 1,00
- Ba: 0,89
- Zn: 1,65
- Hg: 2,00
- Li: 0,98
- Na: 0,93
- K: 0,82
- Cu: 1,90
- Ag: 1,93
Μεγαλύτερη ηλεκτραρνητικότητα σημαίνει ισχυρότερη έλξη των ηλεκτρονίων. Όταν ενώνονται άτομα με διαφορά ηλεκτραρνητικότητας 0,00 - 0,40 δημιουργείται ένας μη πολωμένος (ή ελάχιστα πολωμένος) ομοιοπολικός δεσμός.
Οι πιο συνηθισμένοι μη πολωμένοι (ή ελάχιστα πολωμένοι) ομοιπολικοί δεσμοί στην Οργανική Χημεία είναι οι ακόλουθοι:
- C - C.
- C - H.
- C - I.
- C - S.
- C - Se.
- C - Pb.
- H - Se.
- H - Te.
- H - P.
- H - As.
- H - Sb.
- H - Si.
- S - S.
- N - N.
- P - P.
- Si - Si.
Όταν ενώνονται άτομα με διαφορά ηλεκτραρνητικότητας 0,40 - 1,70 δημιουργείται ένας πολωμένος ομοιοπολικός δεσμός.
Οι πιο συνηθισμένοι πολωμένοι ομοιπολικοί δεσμοί στην Οργανική Χημεία είναι οι ακόλουθοι:
- δ+C - Fδ-.
- δ+C - Clδ-.
- δ+C - Brδ-.
- δ+C - Oδ-.
- δ+C - Nδ-.
- δ-C - Siδ+.
- δ+H - Oδ-.
- δ+H - Nδ-.
Τέλος, ενώνονται άτομα με διαφορά ηλεκτραρνητικότητας 1,70 και πάνω, δημιουργείται πια ένας ιονικός ή ετεροπολικός δεσμός.
Δεσμοί
[επεξεργασία]Ιονικός δεσμός
[επεξεργασία]
Ο ιονικός ή ετεροπολικός δεσμός σχηματίζεται όταν θετικά και αρνητικά φορτισμένα ιόντα ενώνονται σε ένα πλέγμα που συγκρατείται με ηλεκτροστατικές ελκτικές δυνάμεις. Αυτοί οι δεσμοί είναι λίγο ασθενέστεροι σε ισχύ σε σύγκριση με τους ομοιοπολικούς δεσμούς, αλλά πολύ ισχυρότεροι από τους δεσμούς υδρογόνου και τις ακόμη ασθενέστερες δυνάμεις van der Waals.
Στους ιονικούς δεσμούς η ηλεκτραρνητικότητα του στοιχείου που σχηματίζει το ανιόν είναι πολύ μεγαλύτερη (κατά τουλάχιστον 1,7 βαθμούς της κλίμακας Paouling, αν και υπάρχουν ιονικές ενώσεις και μεταξύ στοιχείων με μικρότερη διαφορά ηλεκτραρνητικότητας) από την ηλεκτραρνητικότητα του στοιχείου που σχηματίζει το κατιόν. Έτσι, το άτομο του στοιχείου με τη μεγαλύτερεη ηλεκτραρνητικότητα αποσπά εντελώς ένα ή περισσότερα ηλεκτρόνια από το άλλο με τη μικρότερη.
Το χαρακτηριστικότερο παράδειγμα τέτοιου δεσμού υπάρχει στο χλωριούχο νάτριο (NaCl), στο οποίο τα κατιόντα νατρίου και τα ανιόντα χλωρίου σχηματίζουν κρυσταλλικό πλέγμα σύμφωνα με το κυβικό σύστημα. Σ' αυτό τα μεγαλύτερα ανιόντα χλωρίου τοποθετούνται σε διάταξη κύβου, ενώ τα μικρότερα κατιόντα νατρίου γεμίζουν τα οκταεδρικά κενά μεταξύ τους. Κάθε ιόν περικυκλώνεται από έξι ιόντα του άλλου είδους. Η ίδια βασική δομή βρίσκεται και σε πολλά άλλα ορυκτά.
Οι ηλεκτροστατικές δυνάμεις επεκτείνονται έξω από την τοπική περιοχή του στοιχειώδους κρυστάλλου και οδηγούν συνήθως στο σχηματισμό μεγάλων κρυσταλλικών δομών. Για το λόγο αυτό, οι περισσότερες ιονικές ενώσεις είναι στερεές σε θερμοκρασια δωματίου (20°C).
Ομοιοπολικός δεσμός
[επεξεργασία]Οι ομοιοπολικοί δεσμοί αφορούν τον κορμό της Οργανικής Χημείας. Αυτή είναι η περίπτωση που δύο (σε μερικές περιπτώσεις και περισσότερα από δύο) άτομα συνεισφέρουν μεταξύ τους ηλεκτρόνια, που πρακτικά περιφέρονται πλέον γύρω από δύο (ή περσσότερους) πυρήνες. Τα συνεισφερόμενα ηλεκτρόνια ανήκουν από κοινού στα άτομα που σχηματίζουν το δεσμό, συνυπολογίζονται στον αριθμό ηλεκτρονίων της εξωτερικής στοιβάδας του καθενός ατόμου και η αμοιβαία έλξη τους προς τους δύο (ή περισσότερους) πυρήνες εξασφαλίζει τη συνοχή του δεσμού και κρατά τα άτομα σε σχετικά κοντινή απόσταση. Αυτή η συνεισφορά των ηλεκτρονίων οδηγεί στη δημιουργία μιας χαμηλότερης ενέργειας και άρα σταθερότερη κατάσταση σε σύγκριση με τα δυο (ή περισσότερα) ξεχωριστά άτομα. Άλλωστε οι περισσότερες χημικές αντιδράσεις στη Χημεία γίνονται για τη δημιουργία μιας πιο σταθερής κατάστασης. Οι ομοιοπολικοί δεσμοί είναι οι συνηθισμένοι δεσμοι μεταξύ ατόμων στοιχείων με διαφορά ηλεκτραρνητικότητας ως 1,7. Ειδικά οι δεσμοί μεταξύ ατόμων του ίδιου στοιχείου, π.χ. H2, O2, είναι αναγκαστικά ομοιοπολικοί, γιατί εφόσον η ηλεκτραρνητικότητα των ατόμων είναι η ίδια δεν είναι δυνατός ο σχηματισμός ιονικού δεσμού.
Ο άνθρακας ειδικότερα είναι ιδιαίτερα κατάλληλος για τη δημιουργία ομοιοπολικών δεσμών, γιατί έχει μια σχετικά ενδιάμεση ηλεκτραρνητικότητα, 2,55, και άρα μπορεί να σχηματίζει ομοπολικούς δεσμούς με χημικά στοιχεία με ηλεκτραρνητικότητα από 0,85 και πάνω.
Οι ομοιπολικές ενώσεις έχουν ισχυρούς ενδομοριακούς δεσμούς, αλλά ασθενείς διαμοριακές δυνάμεις. Εξαιτίας των ασθενών διαμοριακών τους δυνάμεων έχουν σχετικά χαμηλά σημεία τήξης και βρασμού, πολύ χαμηλότερα από αυτά των ιονικών ενώσεων. Γι' αυτό είναι πολύ πιθανό να βρίσκονται στην υγρή ή ακόμη και στην αέρια κατάσταση σε θερμοκρασία δωματίου.
Πόλωση δεσμού και διπολική ροπή
[επεξεργασία]
Τα μόρια των χημικών στοιχείων περιέχουν αναγκαστικά μόνο εντελώς μη πολωμένους ομοιοπολικούς δεσμούς. Οι ομοιοπολικοί δεσμοί μεταξύ ατόμων διαφορετικών στοιχείων συνήθως έχουν κάποια διαφορά ηλεκτραρνητικότητας και συνεπώς είναι συνήθως λίγο ή αρκετά πολωμένοι. Το πιο ηλεκτρανητικό άτομο έλκει πιο ισχυρά τα συνεισφερόμενα ηλεκτρόνια, με αποτέλεσμα να βρίσκονται πιο κοντά στο δικό του πυρήνα και έτσι σχηματίζεται ένα σχετικό ηλεκτρικό φορτίο θετικό για το λιγότερο ηλεκτραρνητικό άτομο και αρνητικό για το πιο ηλεκτραρνητικό. Όταν υπάρχει σημαντική διαφορά ηλεκτραρνητικότητας, δηλαδή τουλάχιστον 0,4, ο δεσμός ονομάζεται πολωμένος ομοιοπολικός δεσμός. Όσο μεγαλύτερη η διαφορά ηλεκτραρνητικότητας μεταξύ των στοιχείων που σχηματίζουν τον ομοιοπολικό δεσμό, τόσο περισσότερο πολωμένος είναι ο δεσμός. Η συνολική ανισορροπία φορτίων που σχηματίζεται από τη μερική έστω πόλωση ενός ομοιοπολικού δεσμού εκφράζεται με τη λεγόμενη διπολική ροπή. Όταν ένα μόριο περιέχει περισσότερους από έναν ομοιοπολικούς δεσμούς, ως διπολική ροπή λαμβάνεται η διανυσματική συνισταμένη των επιμέρους διπολικών ροπών του κάθε δεσμού. Για ομοιοπολικές ενώσεις με σημαντικό μέτρο διπολικής ροπής λέμε ότι είναι πολικές ενώσεις, ενώ αν το μέτρο της διπολικής τους ροπής είναι μηδέν ή κοντά σ' αυτό, λέμε ότι είναι μη πολικές. Υπάρχουν ενώσεις μεταξύ στοιχείων με σημαντική διαφορά ηλεκτραρνητικότητας που όμως λόγω της συμμετρίας της δομής τους το μέτρο της διπολικής ροπής τους να είναι μηδενικό ή σχεδόν και γι' αυτό να είναι μη πολικές. Η πιο γνωστή πολική ένωση είναι το νερό. Το υδρογόνο και το οξυγόνο που το αποτελούν έχουν αρκετά μεγάλη διαφορά ηλεκτραρνητικότητας και η γωνιακή δομή του οδηγεί στον υπολογισμό αρκετά μεγάλης διπολικής ροπής.
Οι ιδέες της πόλωσης των δεσμών και της διπολικής ροπής έχουν ένα σημντικό ρόλο ιδιαίτερα στην Οργανική Χημεία, αφού η τελευταία ασχολείται σχεδόν αποκλειστικά με ομοιοπολικές ενώσεις.
Για παράδειγμα, κοιτάζοντας της εικόνα της δομής του μεθανίου, ενός σχετικά απλού αλλά χαρακτηριστικού οργανικού συμμετρικού μορίου. Οι τέσσερεις δεσμοί, που περιέχει, μεταξύ του ατόμου του άνθρακα και των τεσσάρων άτομων υδρογόνου σχηματίζουν ίσες γωνίες 109,5°. Κάθε δεσμός C-H έχει μια μικρή πολικότητα (3%), αφού η διαφορά ηλεκτραρνητικότητας μεταξύ του άνθρακα και του υδρογόνου είναι 2,55 - 2,20 = 0,35. Εξαιτίας της συμμετρίας του όμως, η διπολική ροπή του μορίου είναι μηδέν και έτσι το μεθάνιο είναι ένα μη πολικό μόριο.
Είναι σημαντικό να προσεχθεί η διάκριση μεταξύ των δυο αυτών όρων. Η διπολική ροπή εκφράζει τη συνολική πολικότητα του μορίου, ενώ η πολικότητα των δεσμών εκφράζει τη σχετική πόλωση κάθε δεσμού χωριστά.
Η διπολική ροπή εκφράζει πρακτικά τη συνισταμένη των πολικοτήτων όλων των δεσμών του μορίου μιας χημικής ένωσης.
Ημιπολικός δεσμός
[επεξεργασία]Δεσμοί van der Waals
[επεξεργασία]Η ονομασία δεσμοί van der Waals αποτελεί ένα συνολικό όρο για τους ακόλουθους τρεις τύπους αλληλεπιδράσεων:
- Αλληλεπιδράσεις μεταξύ μόνιμων διπόλων: Πρόκειται για ηλεκτροστατικές έλξεις μεταξύ ετερόνυμων πόλων δυο διπόλων, δηλαδή δυο μορίων που και τα δυο έχουν μη μηδενική διπολική ροπή. Π.χ. αυτού του τύπου οι αλληλεπιδράσεις είναι υπεύθυνες για την ανάπτυξη διαμοριακών δυνάμεων συνοχής μεταξύ μορίων του φθορομεθανίου (CH3F), που δικαιολογούν το σχετικά υψηλό σημείο ζέσης της ένωσης, περίπου -15°C, σε σύγκριση με το παρόμοιας μοριακής μάζας άζωτο (N2, που έχει σημείο ζέσης περίπου -180°C.
- Αλληλεπιδράσεις μεταξύ μόνιμου διπόλου και διπόλου εξ επαγωγής: Πρόκειται για ηλεκτροστατικές έλξεις μεταξύ ετερόνυμων πόλων μιας πολικής ένωσης και μιας μη πολικής, της οποίας όμως το ηλεκτρονικό νέφος επιρεάζεται και προσανατολίζεται με βάση τα ηλεκτρικά φορτία της πολικής, δηλαδή πρακτικά έλκεται περισσότερο προς το θετικά φορτισμένο τμήμα της. Οι δυνάμεις αυτές είναι σαφώς μικρότερες σε σύγκριση με το προηγούμενο είδος. Τέτοιες δυνάμεις εμφανίζονται στις δυνάμεις συνάφειας μεταξύ μορίων μιας πολικής ένωσης και μιας μη πολικής σε ένα μίγμα που περιλαμβάνει τις δυο ενώσεις.
- Αλληλεπιδράσεις μεταξύ προσωρινού διπόλου και διπόλου εξ επαγωγής: Πρόκειται για αλληλεπιδράσεις μεταξύ μη πολικών μορίων. Αυτό συμβαίνει επειδή ακόμη και στα μη πολικά μόρια το ηλεκτρονικό τους νέφος δεν έχει συνέχεια συμμετρική κατανομή. Υπάρχουν πάντα σχετικά μικρά ή μεγάλα χρονικά διαστήματα που το ηλεκτρονικό νέφος έχει μη συμμετρική κατανομή και αυτό έχει ως συνέπεια την εμφάνιση προσωρινών ηλεκτρικών φορτίων στα επιμέρους άτομα που αποτελούν το μόριο. Όταν εμφανίζεται έστω και λίγο ένα ηλεκτρικό φορτίο σε ένα μόριο, αυτό επιρεάζει προσωρινά εξ επαγωγής και τα διπλανά, με αποτέλεσμα την εμφάνιση ελκτικών δυνάμεων μεταξύ τους. Προφανώς πρόκειται για το ασθενέστερο είδος δυνάμεων αλληλεπίδρασης.
Ένα δίπολο μπορεί να δημιουργείται και όταν ένα άτομο ή μοριακό τμήμα έχει υψηλότερη ηλεκτραρνητικότητα από ένα άλλο με το οποίο συνδέεται. Αυτό σημαίνει ότι έλκει τα ηλεκτρόνια πιο κοντά σ' αυτό και έχει μεγαλύτερο μερίδιο κατοχής στα συνεισφερόμενα ηλεκτρόνια. Τα δίπολα μπορούν να ακυρώσουν μια συμμετρία. Π.χ, στο μόριο του διοξειδίου του άνθρακα (CO2: O=C=O), που είναι γραμμικό, δηλαδή τα τρία άτομα είναι διαταγμένα ευθύγραμμα, και επομένως έχει διπολική ροπή μηδέν, λόγω συμμετρίας, αλλά η κατανομή των φορτίων είναι ασύμμετρη, παράγοντας μια μη μηδενική συνολική τετραπολική ροπή, που λειτουργεί παρόμοια με τη διπολική, αλλά είναι πολύ ασθενέστερη.
Οι δεσμοί στις οργανομεταλλικές ενώσεις
[επεξεργασία]Η Οργανομεταλλική Χημεία συνδυάζει θέματα της Ανόργανης Χημείας μ' αυτά της Οργανικής, αφού περιέχουν δεσμούς μεταξύ ατόμων άνθρακα και μετάλλων ή μεταλλοειδών. Οι δεσμοί αυτοί είναι συχνά αρκετά διαφορετικοί από τους συνηθισμένους στην Οργανική Χημεία των υπόλοιπων οργανικών ενώσεων. Είναι δυνατό να μην είναι ξεκάθαρα ιονικοί ή ομοιοπολικοί. Κάθε μέταλλο έχει έναν ιδιαίτερο χαρακτήρα δεσμών, όταν ενώνεται με τον άνθρακα. Π.χ. ο χαλκός στις χαλκοργανικές ενώσεις συμπεριφέρεται διαφορετικά από το μαγνήσιο στις οργανομαγνησιακές ενώσεις. Γι' αυτό οι σχετικά αρχάριοι χημικοί πρέπει μάλλον να επικεντρώνονται πώς να χρησιμοποιούν τις πιο βασικές ενώσεις απλώς μηχανιστικά, αφήνοντας τις εξηγήσεις για το τι ακριβώς συμβαίνει σ' αυτές για αργότερα, όταν θα κατακτήσουν μεγαλύτερη εμβάθυνση και κατανόηση στο θέμα.
Οι βασικές αλληλεπιδράσεις στις οργανομεταλλικές ενώσεις θα αναπτυχθούν περισσότερο σε μια παρακάτω ενότητα.
Ηλεκτρονικές δομές κατά Lewis
[επεξεργασία]Οι ηλεκτρονικές δομές κατά Lewis δίνουν μια χρήσιμη αν και απλοποιημένη αναπαράσταση της διάταξης των ηλεκτρονίων στην εξωτερική στοιβάδα ενός ατόμου.
Κάθε ηλεκτρόνιο αντιπροσωπεύεται με μια τελεία. Έτσι, π.χ. ένα μοναχικό άτομο του υδρογόνου συμβολίζεται με το χημικό του σύμβολο, H, με μια τελεία. Ομοίως, το ένα μοναχικό άτομο του ηλίου παριστάνεται ως He με δυο τελείες, κ.ο.κ..
Αναπαριστάνοντας δυο άτομα που σχημάτησαν έναν ομοιοπολικό δεσμό γίνεται σχεδιάζοντας τα ατομικά τους σύμβολα το ένα κοντά στο άλλο και μια απλή γραμμή μεταξύ τους, που συμβολίζει το συνεισφερόμενο ζεύγος ηλεκτρονίων. Δηλαδή, συνοψίζοντας: Κάθε μη δεσμικό ηλεκτρόνιο παριστάνεται με μια τελεία και κάθε δεσμικό ζεύγος με μια γραμμή.
Π.χ. ο ομοιοπολικός δεσμός στο υδροφθόριο παριστάνεται με το σύμβολο H, για το υδρογόνο, μια απλή γραμμή, για τον απλό ομοιοπολικό δεσμό και το συνεισφερόμενο ζεύγος ηλεκτρονίων, το F, για το φθόριο, και, γύρω από το τελευταίο, έξι επιπλέον τελείες, σε τρία ζευγάρια, που παριστάνουν τα έξι επιπλέον μονήρη €ηλεκτρόνια της εξωτερικής στοιβάδας του ατόμου του φθορίου.
Οι ηλεκτρονικές δομές κατά Lewis είναι χρήσιμες για να επιδειχθούν απλά ομοιοπολικά μόρια, αλλά τα όριά τους είναι προφανή όταν προσπαθεί κανείς να αναπαραστήσει μ' αυτές ακόμη και σχετικά απλά οργανικά μόρια ή και κάποια σχετικά πολύπλοκα ανόργανα. Ακόμη, οι ηλεκτρονικές δομές κατά Lewis δεν έχουν την ικανότητα να αναπαραστήσουν το φυσικό προσανατολισμό των μορίων, και γενικά γίνονται δύσχρηστα για ενώσεις με περισσότεερα από τρία ή τέσσερα άτομα.
Οι ηλεκτρονικές δομές κατά Lewis είναι χρήσιμες για να δώσουν μια αρχική ιδέα για τους ομοιοπολικούς δεσμούς σε μικρά μόρια, αλλά άλλοι τύποι μοριακών μοντέλων έχουν πολύ μεγαλύτερη ικανότητα για να μεταδώσουν τις χημικές έννοιες.
Οπτική αναπαράσταση οργανικών ενώσεων
[επεξεργασία]Η οπτική αναπαράσταση οργανικών ενώσεων είναι απόλυτα κρίσιμη για την κατανόηση της Οργανικής Χημείας. Έχοντας την εικόνα της τρισδιάστατης δομής ενός μορίου στο μυαλό αποκτά κανείς πολύ καλύτερη κατανόηση για το τι συμβαίνει στην Οργανική Χημεία.
Πολλοί άνθρωποι βρίσκουν αυτά τα μοντέλα πολύ χρήσιμα. Υπάρχουν μέρη όπου μπορεί κανείς να αγοράσει τα σχετικά κιτ για φυσική αναπαράσταση, αλλά και ιστότοποι με ανοικτό λογισμικό για εικονική ψηφιακή αναπααράσταση μορίων, όπως το Jmol, δίνοντας τη δυνατότητα τρισδιάστατηε περιστροφής των μοριακών μοντέλων. Με τη χρήση αυτών των μοντέλων κατανοεί καλύτερα τα θέματα ιδιαίτερα της Οργανικής Χημείας.
Οι οργανικοί χημικοί ανέπτυξαν έναν αριθμό από τρόπους περιγραφής των μορίων. Κάποια απ' αυτά δειχνουν πολύ καλά την τρισδιάστατη δομή τους, ενώ κάποια άλλα δεν δείχνουν τα πάντα, θεωρώντας ότι ο χρήστης τους είναι αρκετά έμπειρος για να φανταστεί τα υπόλοιπα χωρίς βοήθεια.
Για παράδειγμα, στην παραπάνω εικόνα, η απλούστερη οργανική ένωση, το μεθάνιο, αναπαριστάνεται με πέντε διαφορετικούς τρόπους. Στο άκρο αριστερό της εικόνας, υπάρχει απλά ο χημικός του τύπος, CH4. Αυτός δηλώνει ότι το μόριο του μεθανίου περιέχει τέσσερα άτομα υδρογόνου και ένα άτομο άνθρακα. Δεν λέει όμως πώς αυτά διατάσσονται. Φυσικά ένας οργανικός χημικός δεν χρειάζεται επιπλέον πληροφορίες για να το καταλάβει. Κάθε οργανικός χημικός γνωρίζει ότι ο sp3 υβριδισμός του ατόμου του άνθρακα οδηγεί σε τετραεδρική μοριακή δομή. Παρ' όλα αυτά, σε πιο πολύπλοκα μόρια αυτό δεν είναι τοσο προφανές, ακόμη και για τους καλύτερους οργανικούς χημικούς. Κι αυτό γιατί συχνά, απλά η γνώση της χημικής σύνθεσης δεν συνεπάγεται πάντα μία μόνο δομή.
Το δεύτερο από αριστερά σχέδιο, ο συντακτικός τύπος ή δομή Kekule, προσφέρει λίγο περισσότερες πληροφορίες: Δηλώνει ότι το άτομο του άνθρακα βρίσκεται στο κέντρο του μορίου και ότι τα τέσσερα άτομα υδρογόνου ενώνονται με αυτό. Αυτό αποσαφηνίζει περισσότερο τη δομή της ένωσης, αλλά, δίνει τη λανθασμένη εντύπωση ότι έχουμε ένα επίπεδο μόριο.
Το τρίτο σχέδιο είναι ένα πολύ συνηθισμένος τρόπος αναφοράς δομής ένωσης στην Οργανική Χημεία. Το μόριο του μεθανίου έχει δομή τετραέδρου, με το άτομο άνθρακα στο κέντρο του νοητού γεωμετρικού στερεού και τα άτομα υδρογόνου στις κορυφές του. Το μοντέλο του τρίτου σχεδίου αποδίδει καλύτερα από τα προηγούενα τη μοριακή δομή του άνθρακα. Τα δυο άτομα υδρογόνου που εμφανίζονται στο σχέδιο να συνδέονται με το άτομο του άνθρακα με συνεχείς γραμμές υποτίθεται ότι βρίσκονται στο επίπεδο της οθόνης (ή του χαρτιού), μαζί με το άτομο του άνθρακα, φυσικά. Το άτομο που εμφανίζεται να συνδέται με τη σφηνοειδή γραμμή με το άτομο του άνθρακα υποτίθεται ότι βρίσκοται μπροστά από το επίπεδο της οθόνης (ή του χαρτιού). Τέλος, το άτομο που εμφανίζεται να συνδέται με τη διακεκομένη γραμμή με το άτομο του άνθρακα υποτίθεται ότι βρίσκοται πίσω από το επίπεδο της οθόνης (ή του χαρτιού). Αυτός είναι ένας συχνά χρησιμοποιούμενος τρόπος απεικόνισης της μοριακής δομής και δίνει μια καλή ιδέα για την τρισδιάστατη δομή μέχρι και μορίων μεσαίας πολυπλοκότητας.
Για πολύ πολύπλοκες δομές, μερικές φορές χρειάζονται αναπαραστάσεις σαν την 4η και την 5η από αριστερά δομές της παραπάνω εικόνας.
Πιο συγκεκριμένα, στην 4η από αριστερά δομή της παραπάνω εικόνας, το άτομο του άνθρακα αναπαριστάνεται με μια γκρι (αν και πιο συχνά χρησιμοποιείται το μαύρο χρώμα για τον άνθρακα) σφαίρα και τα άτομα του υδρογόνου με λευκές. Οι δεσμοί αναπαριστάνονται με ράβδους.
Τέλος, στην 5η από αριστερά δομή της παραπάνω εικόνας, το άτομο του άνθρακα αναπαριστάνεται με το γκρι (αν και πιο συχνά χρησιμοποιείται το μαύρο χρώμα για τον άνθρακα) τμήμα των ράβδων που παριστάνουν τους δεσμούς και κάθε άτομο υδρογόνου με κάθε λευκό τμήμα των ράβδων.
Η διαφορά στη χρησιμότητα είναι πιο εμφανής στο παρακάτω πιο πολύπλοκο παράδειγμα απεικόνισης οργανικής ένωσης:
Η παραπάνω εικόνα δείχνει πέντε διαφορετικές αναπαριστάσεις του μορίου του κυκλοεξανίου. Σημειώστε ότι αυτήν τη φορά ο χημικός τύπος της ένωσης, C6H12 παραλήφθηκε, γιατί δεν αντιστοιχεί πια μόνο σε μια ένωση, αλλά σε αρκετές ισομερείς (δείτε σε παρακάτω ενότητα για την έννοια). Το κυκλοεξάνιο αποτελείται από ένα δακτύλιο από έξι συνδεμένα μεταξύ τους άτομα άνθρακα, που το καθένα τους συνδέεται με δυο άτομα υδρογόνου. Η 1η δομή από αριστερά της εικόνας, όντως δείχνει το δακτύλιο των έξι ατόμων άνθρακα και το ότι ενώνονται με δυο άτομα υδρογόνου το καθένα. Πολλές φορές το σχήμα απλοποιείται περισσότερο, με το σχεδιασμό ενός απλού εξαγώνου, δηλαδή ![]() , οι κορυφές του οποίου παριστάνουν τα άτομα άνθρακα, ενώ τα άτομα υδρογόνου απλώς εννοούνται.
, οι κορυφές του οποίου παριστάνουν τα άτομα άνθρακα, ενώ τα άτομα υδρογόνου απλώς εννοούνται.
Η 2η από αριστερά δομή της παραπάνω εικόνας δείχνει τα ίδια με την πρώτη με τη διαφορά ότι προσπαθεί να δείξει το εξάγωνο υπό μια γωνία.
Η 3η από αριστερά δομή της παραπάνω εικόνας δείχνει μια αναπαράσταση του μορίου με σφαίρες και ράβδους, όπως η 4η από αριστερά δομή του μεθανίου, στην προηγούμενη εικόνα. Όπως μπορείτε να διαπιστώσεται με μια προσεκτική ματιά, η δομή αυτή διευκρινίζει ότι τα έξι άτομα του άνθρακα δεν διατάσσονται στο ίδιο επίπεδο. Αυτή η συγκεκριμένη διαμόρφωση του κυκλοεξανίου που εικονίζεται σ' αυτήν τη δομή ονομάζεται «διαμόρφωση ανάκλιντρου». Με τις διαμορφώσεις του κυκλοεξανίου και των υπόλοιπων κυκλοαλκανίων θα ασχοληθεί μια άλλη ενότητα, παρακάτω.
Η 4η από αριστερά δομή της παραπάνω εικόνας δείχνει μια αναπαράσταση του μορίου μόνο με ράβδους, όπως η 5η από αριστερά δομή του μεθανίου, στην προηγούμενη εικόνα. Αποδίδει κι αυτή τη δομή του ανάκλιντρου και μάλλον με κάπως μεγαλύτερη σαφήνεια.
Τέλος, η 5η από αριστερά δομή της παραπάνω εικόνας δείχνει μια αναπαράσταση του μορίου μόνο με σφαίρες και χωρίς τις ράβδους που θα έδειχναν τους δεσμούς. Αν και αποδίδει πιο πιστά την πραγματική εικόνα του μορίου του κυκλοεξανίου και τις επιφάνειες van der Waals, δεν κάνει εμφανή τη δομή του ανάκλιντρου και δεν διευκολύνει στην εξαγωγή ικανοποιητικών συμπερασμάτων από τους χρήστες της. Για το λόγο αυτό, αυτού του είδους οι αναπαραστάσεις είναι λιγότερο προτιμιταίες συνήθως στην Οργανική Χημεία.
Ηλεκτρονικοί μηχανισμοί
[επεξεργασία]Επαγωγικό φαινόμενο
[επεξεργασία]Επαγωγικό λέγεται το φαινόμενο το οποίο περιγράφει την έλξη ηλεκτρονίων σ δεσμών, λόγω διαφορετικής ηλεκτραρνητικότητας των ατόμων.
Συντονισμός, συζυγιακό φαινόμενο και μεσομέρεια
[επεξεργασία]Η μεσομέρεια αναφέρεται σε μοριακές δομές που δεν αναπαριστάνονται εύκολα και με απλό τρόπο, αλλά αποτελούν μια ενδιάμεση κατάσταση ανάμεσα δυο ή περισσότερες σχεδιασμένες δομές.
Η έννοια της μεσομέρειας φαίνεται συχνά δυσκολονόητη σε αρκετά χημικά εγχειρίδια που δεν κατορθώνουν να την εξηγήσουν ικανοποιητικά. Επειδή οι αρχές της εντροπίας δεν μπορούν να εφαρμοστούν σε ξεχωριστά μόρια, είναι αδύνατο να πει κανείς αν μια δεδομένη ένωση με μεσομερή δομή βρίσκεται στη μια ή στην άλλη διαμόρφωση. Η πραγματική κατάσταση της ένωσης σε μοριακή κλίμακα είναι ότι κάθε εμφανιζόμενη πιθανή διαμόρφωση έχει ένα ποσοστό συμμετοχής στην τελική δομή. Το αποτέλεσμα είναι ένα χαρμάνι όλων των πιθανών μεσομερών διαμορφώσεων. Οι αλλαγές στο μοριακό σχήμα συμβαίνουν στην πραγματικότητα τόσο γρήγορα και σε τόσο μικρή κλίμακα που οι φυσικές τοποθεσίες των ανεξάρτητων ηλεκτρονίων δεν είναι δυνατό να καθοριστούν με ακρίβεια, σύμφωνα άλλωστε και με την αρχή απροσδιοριστίας του Heisenberg. Το συμπέρασμα από όλη αυτή τη φαινομενική πολυπλοκότητα είναι απλά: τα μόρια με μεσομερείς διαμορφώσεις συμπεριφέρονται σαν μίγματα των διαφορετικών μορφών, με μεγαλύτερη πιθανότητα εμφάνισης στις πιο σταθερές διαμορφώσεις.
Οι πυρήνε των ατόμων στα μόρια με μεσομερείς διαμορφώσεις δεν κινούνται το ένα σε σχέση με το άλλο όταν παριστάνονται με τις σχεδιαζόμενες μεσομερείς δομές. Αντίθετα, τα ηλεκτρόνια φαίνονται να μετακινούνται από άτομο σε άτομο. Στην πραγματική κατάσταση κανείς δεν μπορεί να πει πού βρίσκεται το κάθε ηλεκτρόνιο σε μια συγκεκριμένη χρονική στιγμή, αλλά απλά ποια πιθανότητα υπάρχει να βρίσκεται σε κάθε πιθανή θέση.
Οι μεσομερείς δομές σταθεροποιούν επιπλέον τα μόρια, γιατί επιτρέπουν στα ηλεκτρόνια που μετέχουν σ' αυτές να επεκτείνουν τα μήκη υλοκύματός τους και έτσι να μειώνουν την ενέργειά τους. Αυτός είναι και ο λόγος που το βενζόλιο (PhH) έχει χαμηλότερη θερμότητα σχηματισμό από αυτόν που πρόβλεψαν οι χημικοί παίρνοντας υπόψη τις ξεχωριστές μεσομερείς διαμορφώσεις του και όχι και την επιπλέον σταθεροποίηση που προσφέρει η ύπαρξη της μεσομέρειας. Τα άλλα αρωματικά μόρια έχουν παρόμοια σταθερότητα, η οποία οδηγεί στη συνολική εντροπική συμπεριφορά της αρωματικότητας (δείτε την οικεία ενότητα, για επιπλέον σχετικές εξηγήσεις). Η μεσομερής σταθεροποίηση έχει έναν κυρίαρχο ρόλο στην Οργανική Χημεία, χάρη στη χαμηλή ενέργεια σχηματισμού των ενώσεων με μεσομερή μόρια.
Ένα παράδειγμα μεσομέρειας είναι το ακόλουθο:
Το παραπάνω σχήμα απεικονίζει τις τρεις μεσομερείς διαμορφώσεις του καρβονικού ανιόντος (CO32-). Χρησιμοποιώντας εργαστηριακές διεργασίες για να μετρήσουμε το μήκος του κάθε δεσμού δεν βρίσκουμε ότι ο ένας δεσμός είναι βραχύτερος από τους άλλους (όπως θα ήταν αν είχαμε εντοπισμένο το διπλό δεσμό) αλλά ότι όλοι οι δεσμοί έχουν ίσο μήκος ενδιάμεσο του μήκους ενός απλού και ενός διπλού δεσμού.
Πιο χαρακτηριστικό παράδειγμα μεσομέρειας είναι το ακόλουθο:
Μεσομερείς δομές
[επεξεργασία]Οι μεσομερείς δομές είναι διαγραμματικά εργαλεία που χρησιμοποιήθηκαν κυρίως στην Οργανική Χημεία για να συμβολίσους μεσομερείς δεσμούς ανάμεσα σε άτομα που μετέχουν σε μόρια. Η ηλεκτρονική πυκνότητα αυτών των δεσμών διαχέεται σε μέρος ή στο σύνολο του μορίου. Οι συμμετέχοντες στη μεσομέρεια όροι για το ίδιο μόριο έχουν όλοι τον ίδιο χημικό τύπο και το ίδιο δίκτιο σ δεσμών, αλλά τα π ηλεκτρόνια μπορεί να κατανέμονται διαφορετικά ανάμεσα στα άτομα. Επειδή τα διαγράμματα κατά Lewis συχνά αδυνατούν να αναπαραστήσουν την πραγματική κατάσταση της δομής ενός μορίου, οι μεσομερείς δομές συχνά χρησιμοποιούνται για την αναπαράσταση αυτή. Οι διάφορες μεσομερείς δομές διαχωρίζονται μεταξύ τους με το σύμβολο ↔. Αν και η μεσομέρεια χρησιμοποιείται πιο συχνά στην Οργανική Χημεία, είναι επίσης χρήσιμη και στην Ανόργανη. Π.χ. ανόργανα χημικά είδη με μεσομέρεια είναι τα ανθρακικά (CO32-) και τα νιτρικά (NO3-) ανιόντα.
Κρίσιμα στοιχεία για τη μεσομέρεια
[επεξεργασία]- Η μεσομέρεια συμβαίνει επειδή επικαλύπτονται τροχιακά. Οι διπλοί και τριπλοί δεσμοί δημιουργούνται με π δεσμούς από την πλάγια επικάλυψη p τροχιακών (μερικές φορές και d). Αυτά τα π μοριακά τροχιακά συχνά επέκτείνονται και σε πάνω από δύο άτομα, με αποτέλεσμα ο δεσμός να διαχέεται.
- Τα μονήρη ζεύγη ηλεκτρονίων και τα μονήρη ηλεκτρόνια επίσης μπορούν να διαχέονται, αλλά όλα τα ηλεκτρόνια πρέπει να μετέχουν σε ένα π σύστημα.
- Αν τα τροχιακά δεν επικαλύπτονται οι δομές που προκύπτουν δεν είναι μεσομερείς, και αυτές οι περιπτώσεις δεν πρέπει να συγχέονται.
- Τα μόρια και τα χημικά είδη γενικότερα με μεσομέρεια θεωρούνται γενικά πιο σταθερά από τυχόν αντίστοιχα που δεν έχουν. Η διάχυση των ηλεκτρονίων μειώνει τις τροχιακές ενέργειες, αυξάνοντας τη σταθερότητα. Π.χ. η μεσομέρεια του βενζολίου δημιουργεί την αρωματικότητα της ένωσης. Το ενεργειακό κέρδος σε σταθερότητα ονομάζεται ενέργεια μεσομέρειας.
- Όλες οι μεσομερείς δομές έχουν το ίδιο δίκτυο σ δεσμών. Επίσης πρέπει η καθεμιά τους να είναι σωστές δομές κατά Lewis, με τον ίδιο αριθμό ηλεκτρονίων και επομένως το ίδιο ηλεκτρικό φορτίο, αλλά και τον ίδιο αριθμό μονήρων ηλεκτρονίων. Οι μεσομερείς δομές με αυθαίρετο διαχωρισμό φορτίου ή και με λιγότερους ομοιοπολικούς δεσμούς είναι συνήθως μη σημαντικές και γι' αυτό έχουν μικρή ή και μηδενική συμμετοχή στη συνολική περιγραφή του μεσομερούς δεσμού. Παρ' όλα αυτά είναι σημαντικές σε μερικές περιπτώσεις όπως σε μια καρβονυλική ομάδα.
- Η υβριδική δομή ορίζεται ως η υπέρθεση των μεσομερών δομών. Π.χ. ο βενζολικός δακτύλιος συχνά παριστάνεται με έναν κύκλο μέσα σε ένα εξάγωνο, αντί για τους εναλλακτικούς διπλούς δεσμούς. Μεσομερείς δομές με διαφορετικές πολλαπλότητες δεσμών συχνά παριστάνονται υβριδικά με συνδυασμό συνεχόμενων και διακεκομένων γραμμών.
Τι δεν είναι μεσομέρεια
[επεξεργασία]Οι μεσομερείς δομές δεν αναπαριστούν ξεχωριστές, απομονώσημες δομές, που αποτελούν διαφορετικές ενώσεις. Στην περίπτωση του βενζολίου, για πάράδειγμα, υπάρουν δυο σημαντικές μεσομερείς δομές που μπορούν να αναπαρασταθούν ως 1,3,5-κυκλοεξατριένια. Υπάρχουν και άλλες πιθανές μεσομερείς δομές, αλλά έχουν υψηλότερο ενεργειακό επίπεδο από τα κυκλοεξατριένια και γι' αυτό έχουν μικρότερη σημασία και συμμετοχή στην πραγματική ηλεκτρονική δομή του βενζολίου. Ωστόσο, αυτό δεν σημαίνει ότι υπάρχουν δυο διαφορετικές και ανεξάρτητες μορφές του βενζολίου και η πραγματική ηλεκτρονική δομή της ένωσης είναι ένας μέσος όρος των δυο δομών. Τα μήκη των έξι C-C δεσμών είναι τα ίδια και το γεγονός αυτό είναι αταίριαστο για πραγματικά κυκλοεξατριένια. Η μεσομέρεια, επίσης δεν πρέπει να συγχέεται με μια χημική ισορροπία, δηλαδή με μια ταυτομέρεια, μεταξύ διαφορετικών ενώσεων με διαφορετικά δίκτυα σ δεσμών. Η υπερσυζυγία είναι μια ιδιαίτερη περίπτωση μεσομέρειας.
Σύντομο ιστορικό της μεσομέρεια
[επεξεργασία]Η έννοια της resonance (ο ένας αγγλόφωνος όρος για τη μεσομέρεια) προτάθηκε αρχικά από τον Linus Pauling το 1928΄. Είχε εμπνευστεί από την κβαντομηχανική συμπεριφορά του διυδρογονοκατιόντος (H2+), στο οποίο το ηλεκτρόνιο εντοπίζεται μεταξύ των δυο πυρήνων υδρογόνου. Ο εναλλακτικός ελληνικής προέλευσης όρος mesomerism είναι δημοφιλής σε γερμανικά και γαλλικά εγχειρίδια και προτάθηκε από τον Christopher Ingold το 1938, αλλά δεν κυριάρχησε αρκετά στην αγγλόφωνη βιβλιογραφία, στην οποία ο όρος έχει ένα σχετικό, αλλά όχι απόλυτα ίδιο νόημα. Το διπλό βέλος ανάμεσα στις μεσομερείς δομές προτάθηκε από το Γερμανό χημικό Arndt, ο οποίο προτιμούσε για τη μεσομέρεια τον όρο zwischenstufe που κατά λέξη σημαίνει ενδιάμεση φάση.
Παραδείγματα μεσομέρειας
[επεξεργασία]Το μόριο του όζοντος (O3) αναπαριστάνεται με δυο μεσομερείς δομές, στην κορυφή του προηγούμενου σχήματος. Στην πραγματικότητα όμως, τα δυο ακραία άτομα οξυγόνου είναι ισοδύναμα και μια υβριδική δομή που παριστάνεται στο πάνω δεξιό μέρος της εικόνας, με ένα φορτίο -1/2 και στα δυο άτομα και μερικώς διπλούς δεσμούς μεταξύ των τριών ατόμων οξυγόνου. Στο μέσο της εικόνας παριστάνεται η περίπτωση μεσομέρειας του βενζολίου, με τις δυο συμβατικές μεσομερείς δομές αριστερά και την υβριδική δομή δεξιά. Η ανακάλυψη αυτής της δομής υπήρξε μια μεγάλη καινοτομία για τη χημεία της εποχής από τον Kekule. Οι δυο τύποι δακτυλίου που αναπαριστούν τη συνολική μεσομέρεια συνδυάζονται στην υβριδική δομή με τον κύκλο, στο μέσο δεξιά της εικόνας. Τέλος, στο κάτω μέρος της εικόνας απεικονίζεται το χημικό είδος του αλλυλικού κατιότος (CH2=CHCH2+), με τις δυο μεσομερείς του δομές και την υβριδική δομή με το θετικό δορτίο σε διάχυση μεταξύ των δυο ακραίων μεθυλενικών ομάδων.
Το υπερσυζυγιακό φαινόμενο
[επεξεργασία]Εξίσωση Hammett
[επεξεργασία]Οξέα και βάσεις
[επεξεργασία]Ορισμός κατά Arrhenius
[επεξεργασία]Ο πρώτος ορισμός για τα οξέα και τις βάσεις προτάθηκε το 1800 από το Σουηδό επιστήμονα Svante Arrhenius. Ο ορισμός κατά Arrhenius ήταν:
Οξύ είναι οποιαδήποτε ουσία διαλύεται στο νερό και δίνει κατιόντα υδρογόνου (H+, όπως το στομαχικό υδροχλωρικό οξύ, HCl).
Βάση είναι οποιαδήποτε ουσία διαλύεται στο νερό και δίνει ανιόντα υδροξυλίου (OH-, όπως το υδροξείδιο του νατρίου, NaOH).
Τα οξέα και οι βάσεις χρησιμοποιούνταν ήδη ευρύτατα σε διάφορες εφαρμογές πριν από την εποχή του Arrhenius, και ο ορισμός του ήταν μια προσπάθεια για να εξηγηθούν τα σχετικά φαινόμενα που ήταν γνωστά από πολύ παλιά.
Παρόλο που ο ορισμός είναι πολύ απλοποιημένος, ο ορισμός αυτών των δυο τύπων χημικών ουσιών είναι σημαντικός. Επιτρέπει στους χημικούς να εξηγήσουν μια σειρά αντιδράσεων με τη χρήση ιονικής χημείας και επίσης επεκτείνει την ικανότητά τους να προβλέψουν το αποτέλεσμα πολλών χημικών αντιδράσεων. Ωστόσο, ο ορισμός αυτός δημιουργεί και μερικά ερωτηματικά, αφού δεν εξηγεί πολλούς τύπους αντιδράσεων που δεν εμπλέκουν ανιόντα υδροξυλίου ή κατιόντα υδρογόνου.
Ο ορισμός αυτός συνεχίζει να χρησιμοποιείται σε σχετικά χαμηλού επιπέδου μαθήματα γενικής χημείας, αλλά οι σύγχρονοι οργανικοί χημικοί χρειάζονται επιπλέον εξηγήσεις για τη διάκριση μεταξύ οξέον και βάσεων, απ' αυτές που παρείχε ο ορισμός κατά Arrhenius.
Ορισμός κατά Brønsted-Lowry
[επεξεργασία]Ένας νεώτερος ορισμός για τα οξέα και τις βάσεις, μετά από αυτόν που προτάθγκε από τον Arrhenius, προτάθηκε ανεξάρτητα από τους Johannes Nicolaus Brønsted και Thomas Martin Lowry το 1923. Ο νέος ορισμός δεν εξαρτούσε τις οξεοβασικές ιδιότητες από τη διάλυση των ουσιών σε νερό. Συγκεκριμένα, ο νεώτερος ορισμός πρότεινε ότι: Η προσφορά πρωτονίου σε μια αντίδραση ορίζει συμπεριφορά οξέος και η αποδοχή του πρωτονίου σε μια αντίδραση ορίζει συμπεριφορά βάσης. Δηλαδή:
Κάθε δότης πρωτονίου είναι οξύ και κάθε δέκτης πρωτονίου είναι βάση.
Το μεγάλο πλεονέκτημα του αναβαθμισμένου αυτού ορισμού ήταν ότι αναγνώριζε ότι η οξεοβασική συμπεριφορά δεν περιορίζεται σε υδατικά διαλύματα. Αυτό επέτρεψε στους χημικούς να εξηγήσουν και ένα μεγάλο αριθμό από αντιδράσεις που λαμβάνουν χώρα σε διαφορετικούς πρωτικούς και απρωτικούς διαλύτες, εκτός από το νερό, ακόμη και στην αέρια ή στερεά φάση, αν και τέτοιου είδους αντιδράσεις (σ' αυτές τις φάσεις) είναι πιο σπάνιες.
Για παράδειγμα, ένα υποθετικό οξύ HA διίσταται σε H+ και A-:
Ο ορισμός κατά Brønsted-Lowry για την οξεοβασική συμπεριφορά είναι ο ένας από τους δυο ορισμούς που είναι ακόμη σε χρήση από τους σύγχρονους χημικούς.
Ορισμός κατά Lewis
[επεξεργασία]Ο δεύτερος ορισμός που χρησιμοποιείτα πλέον ευρύτατα χρησιμοποιεί ως κριτήριο οξεοβασικής συμπεριφοράς την ικανότητα ενός μορίου να δέχεται ή να δίνει ηλεκτρόνια αντί της ικανότητας να δείνει ή να δέχεται πρωτόνια. Ο ορισμός αυτός επεκτείνει ακόμη περισσότερο την οξεοβασική συμπεριφορά των ουσιών, ακόμη και σ' αυτές που δεν περιέχουν υδρογόνο, όπως στην παραδοσιακή οξεοβασική χημεία.
Σύμφωνα με τον ορισμό κατά Lewis:
Κάθε δέκτης ηλεκτρονίων είναι οξύ κατά Lewis και κάθε δότης ηλρκτρονίων είναι βάση κατά Lewis.
Πιθανότατα το πιο σημαντικό θέμα μ' αυτόν τον ορισμό είναι ποιοι τύποι ατόμων και γενικότερα χημικών ειδών μπορούν να δώσουν ηλεκτρόνια και ποιοι τύποι μπορούν να τα λάβουν. Ιδιαίτερα άτομα με μονήρη ζεύγη στην εξωτερική τους στοιβάδα έχουν την ικανότητα να τα χρησιμοποιούν για να έλξουν άτομα ή ιόντα με έλλειμα ηλεκτρονίων. Αυτός είναι ο λόγος, π.χ., που η αμμωνία (NH3) μπορεί να συνδεθεί με ένα τέταρτο υδρογονοκατιόν και να δημιουργήσει το κατιόν αμμωνίου (NH4 +). Το μονήρες ζεύγος ηλεκτρονίων του αζώτου έλκει το ελεύθερο υδρογονοκατιόν σε ένα διάλυμα και το κρατά σχηματίζοντας το κατιόν αμμωνίου. Για τον ίδιο λόγο το μεθάνιο (CH4) δεν μπορεί να ενωθεί με υδρογονοκατιόν για να δώσει μεθανοκατιόν (CH5+), κάτω από συνηθισμένες συνθήκες: Ο άνθρακας στο μεθάνιο δεν διαθέτει μονήρες ζεύγος ηλεκτρονίων, όπως το άζωτο στην αμμωνία. Γενικά μερικά από τα οξέα κατά Lewis είναι το άζωτο, το οξυγόνο και τα αλογόνα.
Πυρηνόφιλα και ηλεκτρονιόφιλα
[επεξεργασία]Ανάλογα με το αν ένα χημικό είδος μπορεί να δώσει ή να πάρει ηλεκτρόνια ονομάζεται αντίστοιχα πυρηνόφιλο ή ηλεκτρονιόφιλο. Τα ηλεκτρονιόφιλα έλκονται από τα ηλεκτρόνια και γι' αυτό ψάχνουν για μονήρη ζεύγη ηλεκτρονίων από άλλα χημικά είδη. Τα πυρηνόφιλα, με τη σειρά τους, έλκονται από κατιόντα, όπως π.χ. τα υδρόνια (Η+) σε όξινα διαλύματα. Είναι σημαντικό να σημειώσετε ότι τόσο τα ηλεκτρονιόφιλα όσο και τα πυρηνόφιλα μπορεί να είναι άτομα, μόρια ή και ιόντα.
Η κατανόηση των ηλεκτρονιόφιλων και των πυρηνόφιλων παίζει μεγάλο ρόλο στην κατανόηση των οργανικών αντιδράσεων, αφού ξανά και ξανά θα δείτε αντιδράσεις που είναι αποτέλεσμα της επίδρασης πυρηνόφιλων σε ηλεκτρονιόφιλα. Οι έννοιες πυρηνόφιλο και ηλεκτρονιόφιλο είναι σχετικές με τις έννοιες οξύ και βάση, όπως είναι σαφές στην προηγούμενη ενότητα.
Είναι σημαντικό όμως να κατανοηθεί ότι αν και σχετικές μεταξύ τους αυτές οι έννοιες δεν είναι και ταυτιζόμενες. Ένα χημικό είδος μπορεί να είναι ταυτόχρονα ένα ισχυρό πυρηνόφιλο και μια ασθενής βάση (π.χ. N3-, RS-, I-, Br- και CN-), ένα άλλο να είναι ασθενές πυρηνόφιλο και ισχυρή βάση (π.χ. (CH3)3CO- και R2N-), ένα άλλο ισχυρό πυρηνόφιλο και ισχυρή βάση (π.χ. R3C-, RO- και OH-), και τέλος ένα άλλο ασθενές πυρηνόφιλο και ασθενής βάση (π.χ. RCOO-, ROH και NH3).
Όλα τα παραπάνω θα αναλυθούν με μεγαλύτερη λεπτομέρειες στις οικείες ενότητες, αντιδράσεις και μηχσανισμούς αντιδράσεων. Αυτό που πρέπει εν τω μεταξύ να γίνει σαφές είναι ότι τα πυρηνόφιλα είναι βασικά και τα ηλεκτρονιόφιλα όξινα.
pKa και οξύτητα
[επεξεργασία]Η σταθερά όξινης διάστασης (Ka) ενός χημικού είδους εκφράζεται πολύ συχνά ως pKa, δηλαδή τo αντίθετο του αρνητικού δεκαδικού λογάριθμού της. Δηλαδή:
Όσο μικρότερη η τιμή της pKa, τόσο ισχυρότερο οξύ και τόσο ασθενέσθερη βάση είναι το αντίστοιχο χημικό είδος. Υπάρχει και η αντίστοιχη pKb, αλλά το συνηθέστερο, ιδίως στην Οργανική Χημεία, είναι να χρησιμοποιείται η pKa, ακόμη κι αν αναφερόμαστε σε βάσεις. Αυτό γίνεται γιατί υψηλές τιμές pKa αντιστοιχούν σε χαμηλές τιμές pKb και αντιστρόφως. Κάθε pKa > 7 σημαίνει ότι το αντίστοιχο χημικό είδος είναι λιγότερο όξινο και περισσότερο βασικό από το νερό που χρησιμεύει ως μέτρο. Αυτό όμως δε σημαίνει ότι ένα τέτοιο είδος δεν μπορεί να είναι ένα οξύ. Π.χ. οι αλκοόλες έχουν συχνά pKa > 7, αλλά μπορούν να δώσουν H+ σε χημικές αντιδράσεις, αν και όχι τόσο γρήγορα ή εύκολα. Η δυνατότητα αυτή κάνει τις αλκοόλες αυτές όξινες, αλλά ως πολύ ασθενή οξέα. Πολλά από τα οργανικά οξέα είναι πολύ συχνά σχετικά ασθενέστερα από τα συνήθως χρησιμοποιούμενα ανόργανα.
Κσθαρισμός και ανάλυση οργανικών ενώσεων
[επεξεργασία]Μέθοδοι καθαρισμού
[επεξεργασία]Ανακρυστάλλωση
[επεξεργασία]Εξάχνωση
[επεξεργασία]Απόσταξη
[επεξεργασία]Χρωματογραφία
[επεξεργασία]Στοιχειακή ανάλυση οργανικών ενώσεων
[επεξεργασία]Σύνταξη και ταξινόμηση οργανικών ενώσεων
[επεξεργασία]Ονοματολόγία οργανικών ενώσεων
[επεξεργασία]Ονοματολογία σημαίνει ένα σύστημα ονοματοδοσίας. Στην Οργανική Χημεία η ονοματοδοσία μπορεί να είναι κάπως δύσκολη στο χειρισμό της. Πολλές οργανικές χημικές ενώσεις ανακαλύφθηκαν και ονομάστηκαν πριν η σύγχρονη Οργανική Χημεία αρχίσει να συστηματοποιεί τον τρόπο την ονοματοδοσίας. Αυτή η παλαιότερη ονομασία, αν υπάρχει για μια οργανική ένωση, ονομάζεται εμπειρική ονομασία. Από το δεύτερο ήμισυ του 19ου αιώνα άρχησε μια προσπάθεια συστηματοποίησης της ονοματοδοσίας των οργανικών ενώσεων. Αρχικά οι χημικοί χρησιμοποίησαν διαφορετικά συστήματα ονοματοδοσίας και μερικές φορές το ένα επιβάλονταν στο άλλο ή προέκυπτε συνδυάζονταν σε μικτά συστήματα. Η πρακτική αυτή οδήγησε σε μια ποικιλία από ασυνήθιστα και πολύπλοκα ονόματα για κάθε ένωση. Ενώ πολλά τμήματα ονομάτων στην Οργανική Χημεία προέρχονταν από την ελληνική γλώσσα, κάποια άλλα προέρχονταν από τη λατινική. Μερικές φορές προέκυπταν ονομασίες που συνδύαζαν και τις δυο γλώσσες. Για παράδειγμα, πολλές οργανικές ενώσεις ονομάστηκαν με βάση τον αριθμό των ατόμων άνθρακα σε αλυσίδα που περιέχουν στο μόριό τους. Από το 1 ως το 10 τα σχετικά προθέματα είναι: μεθ-, αιθ-, προπ-, βουτ-, πεντ-, εξ-, επτ-, οκτ-, εννεα- ή νον- και δεκ-. Τα πρώτα τέσσερα προέρχονται από την εμπειρική χρήση πριν τη συστηματοποίηση της ονοματοδοσίας. Τα υπόλοιπα, εκτός από το νον-, προέρχονται από την ελληνική ονομασία των αριθμών 5 - 10. Το νον- (που δεν έχει επικρατήσει στην ελληνική ονοματολογία), προέρχεται από τη λατική ονομασία του αριθμού 9.
Η σημερινή τυπική ονοματολογία στην Οργανική Χημεία ονομάζεται ονοματολογία κατά IUPAC. Η IUPAC (International Union of Pure and Applied Chemistry, δηλαδή Διεθνής Ένωση της Καθαρής και της Εφαρμοσμένης Χημείας) έχει γίνει ένα σταθερό σύστημα ονοματοδοσίας για όλλες τις χημικές ενώσεις. Επειδή όμως είναι γνωστές πολλά εκατομμύροα οργανικές ενώσεις και πολλές ποικιλίες παράγωγων χημικών ειδών, μπορεί κανείς να φανταστεί ότι οι σχετικοί κανόνες είναι πολλοί και πολύπλοκοι.
Υπάρχει ένας τόμος ονοματολογίας που αποτελεί το Χρυσό Βιβλίο της IUPAC (IUPAC Gold Book). Ενώ περιγράφει τις διαδικασίες ονοματοδοσίας, αυτό το βιβλίο συχνά παρέχει απλούστερους κανόνες ονοματοδοσίας και δεν περιλαμβάνει όλες τις εξαιρέσεις των κανόνων. Δεν πρόκειται βέβαια να αναλύσουμε εδώ όλες τις πιθανές ποικιλίες ονοματοδοσίας των διαφόρων ενώσεων, αλλά συχνά χρειάζεται να δώσουμε τις πιο συχνά χρησιμοποιούμενες μεθόδους ονοματοδοσίας. Αυτές οι διαδικασίες γενικά δίνουν ένα καλό εφόδιο για σχεδόν όλες τις πιθανές περιπτώσεις. Αν αμφιβάλλετε για τη σωστή ονοματοδοσία κάποιας ένωσης, μπορείτε να συμβουλευτείται το Χρυσό Βιβλίο της IUPAC. Αυτό βέβαια γίνεται σημαντικό όταν δημοσιεύετε άρθρα για τη Χημεία ή όταν μοιράζεστε ανάλογη πληροφόρηση σε σχετικά ευρύ ακροατήριο.
Εκτός από τα μνημειώδη ονόματα των πρώτων ημερών της Χημείας, υπάρχουν επίσης κάποιες περιπτώσεις στην ονοματολογία κατά IUPAC που μπορεί να επιτρέπουν σε μια ένωση να έχει περισσότερα από ένα πιθανό όνομα. Θα βρείτε αρκετές περιπτώσεις στις οποίες υπάρχουν τουλάχιστον δυο ισοδύναμα ονόματα για μια ένωση. Είναι πάντως σημαντικό, για να αποφεύγονται συγχύσεις, να μάθει κανείς καλά την ορολογία της Χημείας, οποιοσδήποτε θέλει να ασχοληθεί με το αντικείμενο, ακόμη και αν αυτή η ορολογία είναι κάπως πολύπλοκη.
Συστηματική ονοματολογία υδρογονανθράκων
[επεξεργασία]Αλκάνια
[επεξεργασία]Αλκάνια χωρίς διακλάδωση
[επεξεργασία]Η ονομασία των χωρίς διακλαδωση αλκανίων χωρίζεται σε δύο (2) τμήματα:
α): Το πρόθεμα που δείχνει τον αριθμό ατόμων άνθρακα της αλυσίδας. Για αλκάνια μέχρι και τέσσερα (4) άτομα άνθρακα χρησιμοποιούνται τα προθέματα μεθ-, αιθ-, προπ- και βουτ-, που δηλώνουν αντίστοιχα ένα (1), δύο (2), τρία (3) και τέσσερα (4) άτομα άνθρακα. Για τα επόμενα χρησιμοποιούνται ελληνικής προέλευσης αριθμητικά προθέματα της μορφής πεντ-, εξ-, κ.τ.λ..
β): Την κατάληξη -άνιο που δηλώνει αλκάνιο[1].
Παραδείγματα:
- CH3(CH2)6CH3: οκτάνιο.
- CH3(CH2)13CH3: δεκαπεντάνιο.
Αλκάνια με διακλάδωση
[επεξεργασία]Η ονομασία των με διακλαδωση αλκανίω χωρίζεται αρχικά σε δύο (2) τμήματα:
α): Την κατάληξη που δηλώνει το όνομα της κύριας ανθρακικής αλυσίδας, δηλαδή της μεγαλύτερης ή πιο πολύπλοκης, δηλαδή αυτής που ενώνεται με τις πιο πολύπλοκες ή μεγαλύτερες διακλαδώσεις. Η ονομασία της γίνεται σαν να ήταν αλκάνιο χωρίς διακλάδωση (δείτε παραδείγματα παρακάτω).
β): Το πρόθεμα που δηλώνει την ύπαρξη διακλαδώσεων. Οι διακλαδώσεις των αλκανίων είναι στην ουσία αλκύλια, δηλαδή αλκάνια από τα οποία λείπει ένα ατομο υδρογόνου. Αυτά ονομάζονται όπως τα αλκάνια, αλλά με κατάληξη -υλ(ο), αντί -άνιο. Η θέση των διακλαδώσεων δηλώνεται (αν είναι απαραίτητο για λόγους διάκρισης ισομερών θέσης) με αριθμούς θέσης πριν από το όνομα κάθε διακλάδωσης. Για να γίνει αυτό αριθμείται η κύρια ανθρακική αλυσίδα από το άκρο που δίνει το μικρότερο δυνατό άθροισμα αριθμών θέσης για τις διακλαδώσεις. Αν σε έναν υδρογονάνθρακα υπάρχουν περισσότερες από μια όμοιες διακλαδώσεις (π.χ. μεθύλια), δηλώνεται με χαρακτηριστικό πρόθεμα δι-, τρι-, κ.τ.λ. ο αριθμός των όμοιων διακλαδώσεων. Αν υπάρχουν περισσότερες από μια ανόμοιες διακλαδώσεις, τότε αυτές μπαίνουν με αλφαβητική σειρά. Π.χ. 3-αιθυλο-2-μεθυλ(ο)- Τέλος είναι δυνατό οι διακλαδώσεις να περιέχουν υποδιακλαδώσεις. Εκτός από μερικές περιπτώσεις (βλέπετε παρακάτω) που έχουν χαρακτηριστικά προθέματα οι άλλες δηλώνονται ως διακλαδώσεις πριν από το κύριο όνομα της διακλάδωσης με τονούμενους αριθμούς θέσης (αν επιβάλλεται). Η αρίθμηση στις διακλαδώσεις ξεκινά πάντα από το άκρο τους που συνδέεται με την κύρια αλυσίδα. Τα αλκύλια με υποδιακλαδώσεις που έχουν ειδικές ονομασίες είναι τα ακόλουθα:
- (CH3)2CH- ισοπροπυλ(ο)-.
- CH3CH2CH(CH3)- ισοβουτυλ(ο)-.
- (CH3)2CHCH2- δευτεροταγές βουτυλ(ο)- (συμβολίζεται συντομογραφικά δ. βουτυλ(ο)-).
- (CH3)3C- τριτοταγές βουτυλ(ο)- (συμβολίζεται συντομογραφικά τ. βουτυλ(ο)-).
- (CH3)2CHCH2CH2- ισοπεντυλ(ο)-.
- CH3CH2C(CH3)2- τριτοταγές πεντυλ(ο)- (συμβολίζεται συντομογραφικά τ. πεντυλ(ο)-).
- (CH3)3CCH2- νεοπεντυλ(ο)-.
Παραδείγματα:
- (CH3)2CHCH2CH2CH3: 2-μεθυλοπεντάνιο.
- CH3CH2CH2CH2CH(CH2CH3)2: 3-αιθυλεπτάνιο.
- (CH3)2CHC(CH3)2CH2CH2CH3: 2,3,3-τριμεθυλεξάνιο.
- CH3CH2CH2CH2CH(CH2CH2CH3)CH2CH(CH2CH3)2: 3-αιθυλο-5-προπυλεννεάνιο.
- (CH3CH2)CH2CH(CH2CH3)CH2CH(CH3)CH2CH2CH3: 3,4-διαιθυλο-6-μεθυλεννεάνιο.
- (CH3)2CHCH2CH2CH2CH2CH(CH3)CH(CH3)CH2CH3: 2,7,8-τριμεθυλοδεκάνιο.
- CH3CH2CH(CH3)CH(CH2CH3)CH2CH2CH3: 4-αιθυλο-3-μεθυλεπτάνιο.
- CH3CH2CH(CH3)C(CH2CH3)(CH2CH2CH3)CH2CH2CH3: 4-αιθυλο-3-μεθυλο-4-προπυλεπτάνιο.
- CH3CH2CH2CH(CH3)CH2C(CH2CH2CH3)3: 4,4-διπροπυλο-6-μεθυλεννεάνιο.
- CH3CH2CH(CH3)CH(CH(CH3)2)CH2CH2CH3: 4-ισοπροπυλο-3-μεθυλεπτάνιο.
- CH3CH2CH2CH2CH(CH(CH3)CH2CH2CH3)CH(CH2CH(CH3)CH2CH3)CH2CH2CH2CH3: 6-(1΄-μεθυλοβουτυλο)-5-(2΄΄-μεθυλοβουτυλ)ενδεκάνιο.
- CH3CH2CH(CH3)CH(CH2CH3)2: 3-αιθυλο-4-μεθυλεξάνιο.
- CH3CH2CH(CH3)CH2CH(CH2CH2CH3)CH2CH(CH2CH3)2: 3-αιθυλο-7-μεθυλο-5-προπυλεννεάνιο.
- CH3CH2CH2CH2CH(CH2CH2CH3)CH2CH(CH3)2: 4-προπυλο-2-μεθυλοκτάνιο.
- CH3CH2CH2CΗ(CH3)CΗ(CH2CH(CH3)CH2CH3)CH2CH2CH2CCH3)3: 6-(2΄-μεθυλοβουτυλο)-2,2,7-τριμεθυλοδεκάνιο.
- (CH3CH2)2CHCH2CH(CH2CH(CH3)CH2CH3)CH2CH2CH2CCH3)3: 8-αιθυλο-2,2-διμεθυλο-6-(2΄-μεθυλοβουτυλο)δεκάνιο.
- CH3CH2CH2CH(CH2CH2CH3)CH2CH(CH2CH(CH(CH3)2))CH2CH2CH3)CH2CH2CH2CH2CH3: 6-(2΄-ισοπροπυλοπεντυλο)-4-(προπυλο)δεκατριάνιο.
Ακόρεστοι άκυκλοι υδρογονάνθρακες
[επεξεργασία]Το όνομα ενός ακόρεστου άκυκλου υδρογονάνθρακα προκύπτει από το αντίστοιχο ενός κορεσμένου με την αντικατάσταση της συλλαβής -αν- με:
- -εν-, -διεν-, -τριεν-, κ.τ.λ. αν η ένωση περιέχει ένα, δύο, τρεις, κ.τ.λ., διπλούς δεσμούς αντίστοιχα.
- -ιν-, -διιν-, -τριιν-, κ.τ.λ. αν η ένωση περιέχει ένα, δύο, τρεις, κ.τ.λ., τριπλούς δεσμούς αντίστοιχα αντίστοιχα.
- -ενιν-, -διενιν, -ενδιιν-, κ.τ.λ. αν η ένωση περιέχει τους αντίστοιχους συνδυασμούς διπλών και τριπλών δεσμών.
Χρησιμοποιούνται αριθμοί θέσης, όταν απαιτείται, που (στην ελληνική ονοματολογία[2]) τοποθετούνται στο τέλος της ονομασίας αν η ένωση έχει ένα είδος πολλαπλών δεσμών. Αν περιέχει συνδυασμό διπλών και τριπλών δεσμών οι αριθμοί θέσης των διπλών τοποθετείται μετά τη συλλαβή -εν- και οι αριθμοί θέσης των τριπλών μετά το τέλος της ονομασίας. Όσο για την προτεραιότητα στην αρίθμηση, προηγούνται οι διπλοί δεσμοί και έπονται οι τριπλοί. Κύρια αλυσίδα θεωρείται αυτή που περιέχει τους περισσότερους πολλαπλούς δεσμούς. Σε περίπτωση ισοδυναμίας πολλαπλών δεσμών λαμβάνονται υπόψη και οι διακλαδώσεις, όπως στους κορεσμένους υδρογονάνθρακες. Η αρίθμηση γίνεται από την άκρη που δείνει τους μικρότερο δυνατό άθροισμα αριθμών θέσης πρώτα των πολλαπλών δεσμών και, σε περίπτωση ισοδυναμίας πολλαπλών δεαμών, και των διακλαδώσεων. Σε περίπτωση που υπάρχουν διακλαδώσεις με πολλαπλούς δεσμούς αυτοί ονομάζονται όπως οι αντίστοιχοι υδρογονάνθρακες αλλά με καταλήξεις -ενυλο, -ινυλο, -ενινλο, κ.τ.λ. Σε περιπτώσεις διακλάδωσης με απεθείας διπλό δεσμό χρησιμοποιείται η κατάληξη -υλιδενο[3]. Αν χρειάζεται αρίθμηση σε διακλάδωση με πολλαπλό δεσμό, η αρίθμηση αρχίζει όπως πάντα από το άκρο που ενώνεται με την κύρια αλυσίδα. Τέλος υπάρχει ένας μικρός αριθμός διακλαδώσεων που έχουν ειδική ονοματολογία:
- CH2= : μεθυλενο-.
- CH2=CH- : βινυλο-.
- CH2=CHCH2- : αλλυλο-.
- CH2=CH(CH3)-: ισοπροπενυλο-.
Παραδείγματα ολόκληρων υδρογονανθράκων:
- CH≡CCH=CH2: βουτενίνιο.
- CH≡CCH2CH=CH2: 4-πεντεν-1-ίνιο.
- CH≡CCH2C≡CCH2CH=CH2: 4,7-οκτεν-1-διίνιο.
- CH3CH=C=CHC≡CH: 1-εξαδιεν-3,4-ίνιο.
- (CH3)3CCH2CH=CHCH3: 5,5-διμεθυλο-2-εξένιο.
- (CH3)2CHCH(CH2CH3)C≡CCH2CH3: 5-αιθυλο-6-μεθυλο-3-επτίνιο.
- CH3CH=CHCH(CH(CH3)2)CH2CH(CH3)2: 4-ισοπροπυλο-6-μεθυλο-2-επτένιο.
- CH≡CC(CH2CH2CH3)=C(CH2CH2CH3)CH=CH2: 3,4-διπροπυλο-5-εξαδιεν-1,3-ίνιο.
- CH2=CHCH=CHCH(C≡CH)CH=CHCH2CH3: 5-αιθινυλο-1,3,6-επτατριένιο.
- CH3C≡CCH(CH=CH2)CH2CH=CH2: 4-βινυλο-5-επτεν-1-ίνιο.
- CH2=CHCH(C≡CH)CH2CH=C=CH2: 5-αιθινυλο-1,2,6-επτατριένιο.
- CH2=CHCH2C(=CH2)CH=CHCH3: 4-μεθυλενο-1,5-εξαδιένιο.
- CH3CH=C(CH2CH3)CH2C(=CH2)CH=CH2: 6-αιθυλο-3-μεθυλενο-1,6-οκταδιένιο.
- CH≡CCH=CHC(=CHCH3)CH2CH=CH-C≡CH: 5-αιθυλιδενο-1,9-δεκαδιέν-3,7-διίνιο.
Παραδείγματα διακλαδώσεων:
- CH≡C-: αιθινυλο-.
- CH3C≡C-: προπιν-1-υλο-.
- CH≡CCH2-: προπιν-2-υλο-.
- CH2=CHCH=CH-: βουταδιεν-1,3-υλο-.
- CH≡CCH2CH=CH-: πεντεν-1-ιν-4-υλο-.
Κυκλικοί υδρογονάνθρακες
[επεξεργασία]Μονοκυκλικοί υδρογονάνθρακες
[επεξεργασία]Το όνομα ενός μονοκυκλικού υδρογονάνθρακα σχηματίζεται από το όνομα του αντίστοιχου άκυκλου, με το επιπλέον πρόθεμα κυκλο-. Ο δακτύλιος θεωρείται η κύρια ανθρακική αλυσίδα, εκτός αν κάποια διακλάδωση θεωρηθεί πιο πολύπλοκη, π.χ. αν περιέχει περισσότερους πολλαπλούς δεσμούς, υποαλυσίδες ή απλά είναι μεγαλύτερη. Επίσης, είναι δυνατό να υπάρχει μια απλούστερη ή μικρότερη κυκλική διακλάδωση.
Παραδείγματα ολόκληρων υδρογονανθράκων:
 : κυκλοβουτάνιο.
: κυκλοβουτάνιο.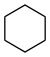 : κυκλεξάνιο.
: κυκλεξάνιο.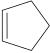 : κυκλοπεντένιο.
: κυκλοπεντένιο. : 1-ισοπροπυλο-3-μεθυλοκυκλεξάνιο.
: 1-ισοπροπυλο-3-μεθυλοκυκλεξάνιο. : κυκλεξαδιένιο-1,3.
: κυκλεξαδιένιο-1,3. : 4,5-διαιθυλο-2-κυκλοεπτυλεπτάνιο.
: 4,5-διαιθυλο-2-κυκλοεπτυλεπτάνιο. : 3-αιθυλο-6-κυκλοκτυλο-5-μεθυλεξένιο-2.
: 3-αιθυλο-6-κυκλοκτυλο-5-μεθυλεξένιο-2.
Παρατηρήσεις, υποσημειώσεις και αναφορές
[επεξεργασία]- ↑ Στην πραγματικότητα δηλώνει την απουσία πολλαπλών δεσμών ή και την ύπαρξη προβλεπόμενων καταλήξεων χαρακτηριστικών ομάδων.
- ↑ Μέρος της ελληνικής βιβλιογραφίας και αρθρογραφίας αντιγράφει ξενόγλωσσες ονοματολογίες, στις οποίες οι αριθμοί θέσης τοποθετούνται στην αρχή του ονόματος της κύριας αλυσίδας.
- ↑ Σε περίπτωση διακλάδωσης με απευθείας τριπλό δεσμό, που δεν υπάρχει σε υδρογονάνθρακες, χρησιμοποιείται η κατάληξη -υλιδινο













