Οργανική Χημεία/Ετεροκυκλικές ενώσεις
Ονοματολογία Ετεροκυκλικών Ενώσεων
[επεξεργασία]Ετεροάτομα στην Οργανική Χημεία ονομάζονται όλα τα άτομα των χημικών στοιχείων που μετέχουν στις οργανικές ενώσεις εκτός από τον άνθρακα και το υδρογόνο.
Ετεροκυκλικές ενώσεις στην Οργανική Χημεία ονομάζονται οι οργανικές ενώσεις που περιέχουν έναν τουλάχιστον δακτύλιο που περιέχει ένα τουλάχιστον ετεροάτομο.
Οι λόγοι που η ονοματολογία τους εξετάζεται ξεχωριστά είναι η αυξημένη πολυπλοκότητα των ενώσεων αυτών και η ύπαρξη ενός ειδικού συστήματος ονοματολογία τους, του συστήματος Hantsch-Widman, πιο εύχρηστου από το επίσημο κατά IUPAC, με αποτέλεσμα να επικρατεί πάρα πολύ συχνά. Συνολικά υπάρχουν οι ακόλουθοι τρόποι ονομασία των ετεροκυκλικών ενώσεων.
- Η εμπειρική ονομασία: Πρόκειται για παλαιότερη ονομασία της ένωσης. Δεν είναι διαθέσιμη για όλες τις ετεροκυκλικές ενώσεις και δεν παρέχει κωδικοποιημένες πληροφορίες για τη σύνθεση ή και τη δομή τους. Π.χ. πυριδίνη.
- Η ημιεμπειρική ονομασία: Πρόκειται για ονομασία που αναφέρει την ένωση ως παράγωγο άλλης ένωσης που διαθέτει εμπιρική ονομασία. Είναι πρακτική για σχετικά απλά παράγωγα ενώσεων με πολύ γνωστά εμπειρικά ονόματα. Περιέχει μερικές κωδικοποιημένες πληροφορίες για τη σύνθεση ή και τη δομή τους, εφόσον είναι πράγματι γνωστή η "μητρική" με την εμπειρική ονομασία. Π.χ. 2-μεθυλοπυριδίνη.
- Η ονομασία κατά IUPAC: Είναι η επίσημη ονομασία που προκυπτει από τη δομή της ένωσης. Η παρουσία των δακτυλίων με ετεροάτομα συχνά επισημαίνεται με πρόθεματα της μορφής εποξυ, επαζω, κτλ.. Π.χ. εποξυαιθάνιο.
- Η ονομασία αντικατάστασης. Είναι η επίσημη ονομασία που προκυπτει από τη δομή της ένωσης που προκύπτει αν προς στιγμή θεωρηθεί ότι τα ετεροάτομά της είναι άτομα άνθρακα και επιπλέον τα ονόματα και, αν είναι απαραίτητο, οι θέσεις των ετεροατόμων τοποθετηθούν στην αρχή της ονομασίας, ως υποκαταστάτες. Ειδικά σε πολύπλοκες ετεροπολικές ενώσεις δίνει την απλούστερη ονομασία. Π.χ. αζενδεκάνιο, για την κορεσμένη ένωση με ενδεκαμελή δακτύλιο και ένα ετεροάτομο αζώτου. Η ίδια ένωση κατά IUPAC θα ονομάζονταν 1,10-επαζωδεκάνιο.
- Η ονομασία κατά Hantsch-Widman. Είναι μια ειδική συστηματική ονομστολογία για ετεροκυκλικές ενώσεις με έναν μόνο και μέχρι και 10μελή δακτύλιο. Θα αναπτυχθεί παρακάτω λεπτομερειακά:
Ονοματολογία κατά Hantsch-Widman
[επεξεργασία]- Η ονομασία του κύριου δακτυλίου της ένωσης διαιρείται σε τρία (3) μέρη:
1. Στο πρόθεμα αναφέρεται με ένα χαρακτηριστικό πρόθεμα το ετεροάτομο ή τα ετεροάτομα του κύριου δακτυλίου. Συγκεκριμένα χρησιμοποιύνται τα ακόλουθα προθέματα για τα πιο συνηθισμένα ετεροάτομα:
- Για το οξυγόνο το οξ(α)-.
- Για το θείο το θει(α)-.
- Για το σελήνιο το σελην(α)-.
- Για το τελλούριο το τελλουρ(α)-.
- Για το άζωτο το αζ(α)-.
- Για το φωσφόρο το φωσφ(α)-, για τον PIII και το φωσφορ-, για τον PV.
- Για το αρσενικό το αρσ(α)-, για το AsIII και το αρσεν-, για το AsV.
- Για το αντιμόνιο το στιμπ(α)- ή αντιμον-. Το τελευυαίο πρόθεμα χρησιμοποιείται μόνο σε εξαμελείς δακτυλίους.
- Για το βισμούθιο το βισμ(α)-.
- Για το πυρίτιο το σιλ(α)-.
- Για το γερμάνιο το γερμ(α)-.
- Για τον κασσίτερο το στανν(α)-.
- Για το βόριο το βορ(α)-.
- Για τον υδράργυρο το μερκουρ(α)-.
2. Ακολουθεί μία χαρακτηριστική συλλαβή που αντιστοιχεί στον αριθμό ατόμων (συνολικά άνθρακα και ετεροατόμων). Συγκεκριμένα:
- Για τρία (3) άτομα στο δακτύλιο χρησιμοποιείται η χαρακτηριστική συλλαβή -ιρ-.
- Για τέσσερα (4) άτομα στο δακτύλιο χρησιμοποιείται η χαρακτηριστική συλλαβή -ετ-.
- Για πέντε (5) άτομα στο δακτύλιο χρησιμοποιείται η χαρακτηριστική συλλαβή -ολ-.
- Για έξι (6) άτομα στο δακτύλιο χρησιμοποιείται η χαρακτηριστική συλλαβή -ιν-.
- Για επτά (7) άτομα στο δακτύλιο χρησιμοποιείται η χαρακτηριστική συλλαβή -επ-.
- Για οκτώ (8) άτομα στο δακτύλιο χρησιμοποιείται η χαρακτηριστική συλλαβή -οκ-.
- Για εννέα (9) άτομα στο δακτύλιο χρησιμοποιείται η χαρακτηριστική συλλαβή -ον-.
- Για δέκα (10) άτομα στο δακτύλιο χρησιμοποιείται η χαρακτηριστική συλλαβή -εκ-.
3. Ακολουθεί μία χαρακτηριστική κατάληξη που αντιστοιχεί στην παρουαία ή απουσία διπλών δεσμών στο δακτύλιο (οι τριπλοί δεν προβλέπονται γιατί είναι σπάνιοι στις κυκλικές ενώσεις και αν υπάρχουν οδηγούν σε πολύ ασταθείς ενώσεις) και στο αν περιέχει άζωυο ως ετεροάτομο ή όχι. Συγκεκριμένα:
- Για τρία (3) έως πέντε (5) άτομα στο δακτύλιο που περιέχει άζωτο ως ετεροάτομο και κανένα διπλό δεσμό χρησιμοποιείται η χαρακτηριστική κατάληξη -ιδίνη. Π.χ. αζιριδίνη, αζετιδίνη, αζολιδίνη.
- Για τρία (3) έως πέντε (5) άτομα στο δακτύλιο που περιέχει άζωτο ως ετεροάτομο και ένα διπλό δεσμό χρησιμοποιείται η χαρακτηριστική συλλαβή -ίνη. Η θέση του διπλού δεσμού δηλώνεται με αριθμούς θέσης. Π.χ. αζιρίνη-1, αζετίνη-1, αζολίνη-1.
- Για τρία (3) έως δέκα (10) άτομα στο δακτύλιο που δεν περιέχει άζωτο ως ετεροάτομο και κανένα διπλό δεσμό χρησιμοποιείται η χαρακτηριστική κατάληξη -άνιο. Π.χ. οξιράνιο, οξετάνιο, οξολάνιο, οξινάνιο, οξεπάνιο, :οξοκάνιο, w:οξονάνιο, οξεκάνιο.
- Για τρία (3) έως πέντε (5) άτομα στο δακτύλιο που δεν περιέχει άζωτο ως ετεροάτομο και ένα διπλό δεσμό χρησιμοποιείται η χαρακτηριστική κατάληξη -ένιο. Η θέση του διπλού δεσμού δηλώνεται με αριθμούς θέσης, αν χρειάζεται. Π.χ. οξιρένιο, οξετένιο, οξολένιο.
- Για τέσσερα (4) έως πέντε (5) άτομα στο δακτύλιο που περιέχει άζωτο ως ετεροάτομο και δύο διπλούς δεσμούς (εναλλάξ με απλούς, αναγκαστικά χρησιμοποιείται η χαρακτηριστική κατάληξη -η. Π.χ. αζέτη, αζόλη
- Για τέσσερα (4) έως έξι (6) άτομα στο δακτύλιο που δεν περιέχει άζωτο ως ετεροάτομο και το μέγιστο δυνατό αριθμό διπλών δεσμών (εναλλάξ με απλούς, αναγκαστικά χρησιμοποιείται η χαρακτηριστική κατάληξη -ιο. Π.χ. οξέτιο, οξόλιο, οξίνιο. Η ίδια χαρακτηριστική κατάληξη χρησιμοποιείται επιπλέον και για εξαμελείς δακτυλίους χωρίς διπλούς δεσμούς, αλλά με το αρχικό πρόθεμα περιυδρο-, δηλώνοντας δηλαδή ότι περιέχουν το μέγιστο δυνατό αριθμό ατόμων υδρογόνου.
- Για επτά (7) έως δέκα (10) άτομα στο δακτύλιο που περιέχει άζωτο ως ετεροάτομο και το μέγιστο δυνατό αριθμό διπλών δεσμών (εναλλάξ με απλούς, αναγκαστικά χρησιμοποιείται η χαρακτηριστική κατάληξη -ίνη. Π.χ. αζεπίνη, αζοκίνη, αζονίνη, αζεκίνη. Για τέτοιυς δακτυλίους και οι ενώσεις χωρίς διπλούς δεσμούς ονομάζονται με τον ίδιο τρόπο, αλλά με το αρχικό πρόθεμα περιυδρο-, δηλώνοντας δηλαδή ότι περιέχουν το μέγιστο δυνατό αριθμό ατόμων υδρογόνου.
- Για επτά (7) έως δέκα (10) άτομα στο δακτύλιο που περιέχει δεν άζωτο ως ετεροάτομο και το μέγιστο δυνατό αριθμό διπλών δεσμών (εναλλάξ με απλούς αναγκαστικά), χρησιμοποιείται η χαρακτηριστική κατάληξη -ίνιο. Π.χ. οξεπίνιο, οξοκίνιο, οξονίνιο, οξεκίνιο.
- Για ακόρεστες ενώσεις με λιγότερους διπλούς δεσμούς από το μέγιστο δυνατό προτάσσονται ως υποκαταστάτες τα επιπλέον άτομα υδρογόνου. Π.χ. Ένωση με εξαμελή δακτύλιο με ετεροάτομο οξυγόνο και ένα διπλό δεσμό ονομάζεται π.χ. 2,3,5,6-τετραϋδροξίνιο. Ένωση με εξαμελή δακτύλιο με ετεροάτομο οξυγόνο και δύο διπλούς δεσμούς ονομάζεται π.χ. 2,3,5,6-τετραϋδροξίνιο.
- Σε ορισμένες περιπτώσεις η ονοματολογία αυτή χρησιμοποιείται και σε συμπυκνωμένα συστήματα. Π.χ. κυκλοπεντα[b]οξίνιο, που θεωρητικά προέρχεται από τη συμπύκνωση κυκλοπενταδιένιου και οξινίου. Σε αυτές τις περιπτώσεις ο πολυπλοκότερος δακτύλιος θεωρείται κύριος και οι άλλοι υποκαταστάτες με την κατάληξη -ο.
Παραδείγματα
[επεξεργασία] Συστηματική ονομασία κατά Hantsch-Widman: αζιρίνη-2.
Συστηματική ονομασία κατά Hantsch-Widman: αζιρίνη-2. Συστηματική ονομασία κατά Hantsch-Widman: θειιράνιο.
Συστηματική ονομασία κατά Hantsch-Widman: θειιράνιο.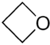 Συστηματική ονομασία κατά Hantsch-Widman: οξετάνιο.
Συστηματική ονομασία κατά Hantsch-Widman: οξετάνιο. Συστηματική ονομασία κατά Hantsch-Widman: στιμπετάνιο.
Συστηματική ονομασία κατά Hantsch-Widman: στιμπετάνιο.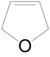 Συστηματική ονομασία κατά Hantsch-Widman: οξολένιο-3.
Συστηματική ονομασία κατά Hantsch-Widman: οξολένιο-3. Συστηματική ονομασία κατά Hantsch-Widman: φωσφολάνιο.
Συστηματική ονομασία κατά Hantsch-Widman: φωσφολάνιο. Συστηματική ονομασία κατά Hantsch-Widman: φωσφορίνιο.
Συστηματική ονομασία κατά Hantsch-Widman: φωσφορίνιο. Συστηματική ονομασία κατά Hantsch-Widman: περυδραζίνη.
Συστηματική ονομασία κατά Hantsch-Widman: περυδραζίνη.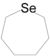 Συστηματική ονομασία κατά Hantsch-Widman: σεληνεπάνιο.
Συστηματική ονομασία κατά Hantsch-Widman: σεληνεπάνιο. Συστηματική ονομασία κατά Hantsch-Widman: 7H-αζεπίνη ή αζεπίνη-1,3,5.
Συστηματική ονομασία κατά Hantsch-Widman: 7H-αζεπίνη ή αζεπίνη-1,3,5. Συστηματική ονομασία κατά Hantsch-Widman: 3,4,5,6-τετραϋδραζοκίνη.
Συστηματική ονομασία κατά Hantsch-Widman: 3,4,5,6-τετραϋδραζοκίνη. Συστηματική ονομασία κατά Hantsch-Widman: 5H-1,2-διαζόλιο ή 1,2-διαζόλιο-1,3.
Συστηματική ονομασία κατά Hantsch-Widman: 5H-1,2-διαζόλιο ή 1,2-διαζόλιο-1,3.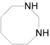 Συστηματική ονομασία κατά Hantsch-Widman: περιυδρο-1,3-διαζοκίνη.
Συστηματική ονομασία κατά Hantsch-Widman: περιυδρο-1,3-διαζοκίνη. Συστηματική ονομασία κατά Hantsch-Widman: 1,3-οξαθειετάνιο.
Συστηματική ονομασία κατά Hantsch-Widman: 1,3-οξαθειετάνιο. Συστηματική ονομασία κατά Hantsch-Widman: 2H-1,2-θειαζίνη ή 1,2-θειαζίνη-3,5.
Συστηματική ονομασία κατά Hantsch-Widman: 2H-1,2-θειαζίνη ή 1,2-θειαζίνη-3,5. Συστηματική ονομασία κατά Hantsch-Widman: 1,2,3,4-τετραϋδρο-1,4-σιλαβορίνη.
Συστηματική ονομασία κατά Hantsch-Widman: 1,2,3,4-τετραϋδρο-1,4-σιλαβορίνη.
Τριμελείς ετεροκυκλικοί δακτύλιοι
[επεξεργασία]Γενικά οι τριμελείς δακτύλιοι, ισοκυκλικοί (κυκλοπροπάνια) και ετεροκυκλικοί, χαρακτηρίζονται δομικά από σχετικά μειωμένες αποστάσεις δεσμών και γωνιών μεταξύ των ατόμων που τους αποτελούν. Αποτέλεσμα αυτών των διαφοροποιήσεων δομής είναι η εμφάνιση μεγάλης τάσης κατά Baeyer, η οποία για το οξιράνιο ανέρχεται στα ~28 kcal/mole.
Οι σπουδαιότερες από τις ενώσεις της κατηγορίας αυτής είναι αυτές που έχουν ως ετεροάτομα το οξυγόνο, το θείο ή το άζωτο. Υπάρχουν όμως και αυτές που περιέχουν και άλλα ετεροάτομα, όπως π.χ. πυρίτιο, βόριο και φωσφόρο. Οι τριμελείς ετεροκυκλικοί δακτύλιοι διανοίγονται με μεγάλη ευκολία, μεγαλύτερη απ' αυτή των τριμελών ισοκυκλικών δακτυλίων, εξαιτίας ακριβώς της ύπαρξης του ετεροατόμου που αποτελεί στόχο διαφόρων πυρηνόφιλων ή ηλεκτρονιόφιλων αντιδραστηρίων.
Η σύνθεσή τους δεν παρουσιάζει γενικά δυσκολίες όταν παράγονται με εσωτερική αντίδραση άκυκλων ενώσεων. Τα άτομα βρίσκονται συχνά σε τριγωνική διάταξη και αυτό διευκολύνει την κυκλοποίηση.
Παλαιότερα οι ενώσεις με τριμελείς δακτυλίους θεωρούνταν χημικά αξιοπερίεργα, αλλά τελευταία έχουν αποκτήσει ικανοποιητική ερμηνεία, χάρη στην Κβαντομηχανική και τους ηλεκτρονικούς υπολογιστές που επιτάχυναν τους σχετικούς υπολογισμούς, αλλά και αυξανομενες εφαρμογές στη σύνθεση πολλών προϊόντων και σε βιομηχανική κλίμακα.
Μερικές μάλιστα βρέθηκαν και στη φύση, έχοντας ενδιαφέρουσες βιοχημικές ιδιότητες.
Το οξιράνιο και παράγωγα του
[επεξεργασία]
Το εποξυαιθάνιο ή οξιράνιο ή αιθυλενοξείδιο είναι ο απλούστερος ετεροκυκλικός αιθέρας. Στις συνηθισμένες συνθήκες (θερμοκρασία 25 °C, πίεση 1 atm), είναι ένα άχρωμο, εύφλεκτο αέριο, με μια γλυκιά οσμή παρόμοια με αυτή του αιθέρα σε τοξικά επίπεδα. Είναι ένα από τα πιο σημαντικά ενδιάμεσα προϊόντα της χημικής βιομηχανίας.
Λόγω της δομής του τριμελούς δακτυλίου έχει υψηλή «ενέργεια τάσης δεσμών», όπως π.χ. και τα ανάλογα μόρια του κυκλοπροπανίου και της αζιριδίνης. Αυτό συνεπάγεται σχετικά εύκολες αντιδράσεις προσθήκης με διάνοιξη του δακτυλίου C-O. Με βάση το χημικό τύπο του, C2H4O, έχει δύο (2) ισομερή θέσης, την αιθανάλη και την ελάσσονα ταυτομερή της αιθενόλη.
Παρόλο που είναι μια ζωτικής σημασίας ενδιάμεση ύλη για τη χημική βιομηχανία, με πολλά χρήσιμα παράγωγα, που περιλαμβάνουν και πολυμερή, το ίδιο το εποξυαιθάνιο είναι μια πολύ βλαβερή ουσία, καθώς στις συνηθισμένες συνθήκες είναι αέριο εύφλεκτο, καρκινογόνο, τερατογόνο, ερεθιστικό και αναισθητικό, με ένα παραπλανητικό ευχάριστο άρωμα.
Η χημική δραστικότητα του εποξταιθανίου που είναι υπεύθυνη για πολλές από τις βλαβερές ιδιότηττές του είναι επίσης υπεύθυνη για το ότι είναι μια ουσία - κλειδί για τη χημική βιομηχανία που υποστηρίζει το επίπεδο ζωής των προηγμένων κοινωνιών. Παρόλο που είναι πολύ επικύνδινο για οικιακή χρήση και σχετικά άγνωστο στους καταναλωτές, το εποξυαιθάνιο χρησιμοποιείται για τη βιομηχανική παραγωγή πολλών καταναλωτικών και μη χημικών προϊόντων και ενδιαμέσων. Είναι κρίσιμο για την παραγωγή απορρυπαντικών, πηκτικών, διαλυτών, πλαστικών και διαφόρων οργανικών χημικών, όπως η αιθανοδιόλη-1,2, οι αιθανολαμίνες, διάφορες απλές και σύνθετες γλυκόλες, οι πολυγλυκολικοί αιθέρες και άλλες ενώσεις. Ως ένα δηλητηριώδες αέριο που δεν αφήνει ίχνη στα αντικείμενα με τα οποία έρχεται σε επαφή, το καθαρό εποξυαιθάνιο είναι ένα αποστειρωτικό που χρησιμοποιείται ευρύτατα από νοσοκομεία και από τη βιομηχανία παραγωγής ιατρικού εξοπλισμού σε αντικατάσταση της χρήσης ατμού σε υλικά που είναι ευαίσθητα στη θερμότητα όπως οι μίας χρήσης πλαστικές σύριγγες.
Σύνοψη της ιστορίας του οξιρανίου
[επεξεργασία]Το οξιράνιο παρασκευάστηκε για πρώτη φορά το 1859 από το Γάλλο χημικό Charles Wurtz με την κατεργασία 2-χλωραιθανόλης με υδροξείδιο του καλίου. Η μέθοδος αυτή χρησιμοποιήθηκε και για τη βιομηχανική παραγωγή του οξιρανίου μέχρι περίπου το 1931, οπότε και ανακαλύφθηκε η μέθοδος που χρησιμοποιείται και σήμερα, η καταλυτική οξείδωση του αιθενίου με μοριακό οξυγόνο ή ατμοσφαιρικό αέρα.
Παραγωγή οξιρανίου
[επεξεργασία]Παραγωγή οξιρανίου από αιθένιο
[επεξεργασία]1. Το οξιράνιο παράγεται σήμερα βιομηχανικά από καθαρό αιθένιο, με οξείδωση από ατμοσφαιρικό αέρα ή καθαρό οξυγόνο, όπως φαίνεται στην παρακάτω αντίδραση:
Η απόδοση της αντίδρασης μπορεί να φθάσει και το 80%. Η παγκόσμια ετήσια παραγωγή είναι 11 εκατομμύρια τόνοι.
2. Εναλλακτικά, η οξείδωση μπορεί να γίνει και με αιθανικό υπεροξύ:
Παραγωγή οξιρανίου από χλωραιθανόλη
[επεξεργασία]Με απόσπαση υδροχλωρίου (HCl) από w:2-χλωραιθανόλη παράγεται οξιράνιο:
Παραγωγή οξιρανίου από μεθανάλη
[επεξεργασία]Με επίδραση μεθυλενίου σε μεθανάλη παράγεται και οξιράνιο:
- Μεγαλύτερη απόδοση σε οξιράνιο έχει η παραγωγή μεθυλενίου με το σύστημα ψευδαργύρου - διιωδομεθανίου, που ευνοεί την παραγωγή κυκλικών ενώσεων:
Παραγωγή οξιρανίου από δι(βρωμομεθυλ)αιθέρα
[επεξεργασία]Με τη χρήση ενδομοριακής αντίδρασης Würtz, από δι(βρωμομεθυλ)αιθέρα
- Όμως η απόδοση αυτής της αντίδρασης είναι σχετικά μικρή, αφού ταυτόχρονα διεξάγεται αναπόφευκτα και διαμοριακή:
- Σήμερα χρησιμοποιείται περισσότερο η τροποποιημένη αντίδραση Freund με ψευδάργυρο, που δίνει μεγαλύτερη απόδοση στην ενδομοριακή αντίδραση. Σ' αυτήν την περίπτωση η στοιχειομετρική εξίσωση της αντίδρασης γίνεται:
Φυσικές και φασματοσκοπικές ιδιότητες του οξιρανίου
[επεξεργασία]Το οξιράνιο είναι αέριο (σημείο ζέσης 10°C) κι έχει διπολική ροπή 1,9 D. Οι αποστάσεις μεταξύ των ατόμων του μορίου του και οι γωνίες των δεσμών του μετρήθηκαν με ακρίβεια με φασματοσκοπία μικροκυμάτων κι έχουν τις ακόλουθες τιμές:
H ενέργεια τάσης δεσμών υπολογίστηκε σε 105 kJ/mol (η αντίστοιχη τιμή για το κυκλοπροπάνιο είναι 117 kJ/mole). Στα φάσματα υπερύθρου η δόνηση του δεσμού C-H εμφανίζεται στην περιοχή των αντίστοιχων των αλκενίων (>C=CH2), δηλαδή γύρω στα 3050 cm-1, ενώ η δόνηση του δεσμού C-O βρίσκεται στην περιοχή των αντίστοιχων των αλκενυλαιθέρων (>C=C-OR), δηλαδή στα 1250 cm-1.
Χημική συμπεριφορά οξιρανίου και παράγωγα
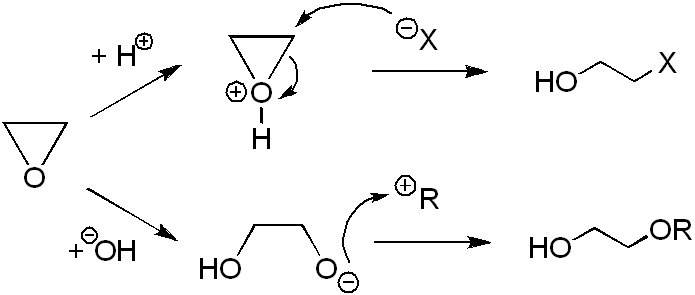
[επεξεργασία]Το οξιράνιο και τα υπόλοιπα οξιράνια (αλκυλιωμένα παράγωγα του εποξυαιθάνιου) χαρακτηρίζονται από αντιδράσεις προσθήκης με διάνοιξη του δακτυλίου. Αντιδρούν εύκολα με πυρηνόφιλα αντιδραστήρια (π.χ. H-, X-, HO-, RO-, RMgI, NH3, κτλ. που παρακάτω συμβολίζονται γενικά ως AB), κατά την ακόλουθη γενική αντίδραση:
Οι αντιδράσεις αυτές είναι τύπου SN2 με αντιπροβολή σε σχέση με το οξυγόνο, με σχηματισμό ρακεμικών και διαστερεομερών μιγμάτων. Σε ορισμένα οξιράνια, με υποκαταστάτες ισχυρούς δέκτες ηλεκτρονίων, όπως π.χ. CN, μπορεί να διασπαστεί ο δεσμός C-C, οπότε με αλκένια, παράγονται οξολάνια.
Προσθήκη ύδατος
[επεξεργασία]Με επίδραση ύδατος έχουμε την εφαρμογή της παραπάνω αναφερόμενης γενικής αντίδρασης για A = OH και B = H. Παράγεται αιθανοδιόλη-1,2. Τα υδατικά διαλύματα εποξυαιθανίου είναι μάλλον σταθερά και μπορούν να διατηρηθούν για μακρά χρονικά διαστήματα χωρίς εμφανή αντίδραση, αλλά αν προσθέσουμε σ' αυτά και μια μικρή ποσότητα οξέος, π.χ. θεικού οξέος, αρχίζει αμέσως να παράγεται η αιθανοδιόλη-1,2, ακόμη και σε θερμοκρασία δωματίου (20°C). Η αντίδραση μπορεί επίσης να πραγματοποιηθεί στην αέρια κατάσταση, δηλαδή με επίδραση υδρατμών, παρουσία ενός φωσφορικού άλατος ως ένας καταλύτης:
Προσθήκη υδριδίου του λιθίου
[επεξεργασία]Με επίδραση υδριδίου του λιθίου έχουμε την εφαρμογή της παραπάνω αναφερόμενης γενικής αντίδρασης για A = H και B = Li. Παράγεται αιθανολικό λίθιο, το οποίο με υδρόλυση δείνει αιθανόλη:
Προσθήκη υδραλογόνου
[επεξεργασία]Με επίδραση υδραλογόνου (HX, όπου Χ = Cl, Br, I) έχουμε την εφαρμογή της παραπάνω αναφερόμενης γενικής αντίδρασης για A = X και B = H. Παράγεται 2-αλαιθανόλη (XCH2CH2OH):
- Η 2-φθοραιθανόλη παράγεται με ανάλογη αντίδραση, αλλά λίγο διαφορετικές συνθήκες: Η επίδραση των άλλων υδραλογόνων γίνεται με υδατικά τους διαλύματα, ενώ αυτή του υδροφθορίου γίνεται από βραστό υδροφθόριο σε διαιθυλαιθέρα που περιέχει 1,5%-2% νερό. Αν χρησιμοποιηθεί άνυδρος αιθέρας, το εποξυαιθάνιο πολυμερίζεται.
- Οι 2-αλοαιθανόλες μπορούν να παραχθούν επίσης με επίδραση υδατικών διαλυμάτων αλογονούχων μετάλλων σε εποξυαιθάνιο. Π.χ. με επίδραση υδατικού διαλύματος χλωριούχου χαλκού σε εποξυαιθάνιο έχουμε την ακόλουθη αντίδραση:
Προσθήκη υδροκυανίου
[επεξεργασία]Με επίδραση υδροκυανίου έχουμε την εφαρμογή της παραπάνω αναφερόμενης γενικής αντίδρασης για A = CN και B = H. Παράγεται 3-υδροξυπροπανονιτρίλιο:
- Το ίδιο προϊόν παράγεται και με επίδραση υδατικών διαλυμάτων κυανιούχων αλάτων. Π.χ. με επίδραση κυανιούχου ασβεστίου έχουμε την ακόλουθη αντίδραση:
Προσθήκη αμμωνίας ή αμινών
[επεξεργασία]1. Με επίδραση αμμωνίας έχουμε την εφαρμογή της παραπάνω αναφερόμενης γενικής αντίδρασης για A = NH2 και B = H. Παράγεται 2-αμιναιθανόλη:
- Συμπαράγονται επίσης δι(2-υδροξυαιθυλ)αμίνη και τρι(2-υδροξυαιθυλ)αμίνη:
2. Με επίδραση πρωτοταγούς αμίνης (RNH2) έχουμε την εφαρμογή της παραπάνω αναφερόμενης γενικής αντίδρασης για A = RNH και B = H. Παράγεται 2-αλκυλαμιναιθανόλη:
3. Με επίδραση δευτεροταγούς αμίνης (R2NH, όπου τα δύο R όχι απαραίτητα ίδια) έχουμε την εφαρμογή της παραπάνω αναφερόμενης γενικής αντίδρασης για A = R2N και B = H. Παράγεται 2-διαλκυλαμιναιθανόλη:
- Οι παραπάνω αντιδράσεις διεγείρονται με την προσθηκη μικρής ποσότητας ύδατος.
- Επειδή οι παραγόμενες αμιναλκοόλες αντιδρούν επίσης με το εποξυαιθάνιο που δεν πρόλαβε να αντιδράσει, συμπαράγονται τα ανάλογα παράγωγα, δηλαδή αμινοπολυαιθυλενογλυκόλες:
4. Με επίδραση υδατικού διαλύματος τριτοταγούς αμίνης (που δρα ως R3NH+OH-, όπου τα τρία R όχι απαραίτητα ίδια) έχουμε την εφαρμογή της παραπάνω αναφερόμενης γενικής αντίδρασης για A = R3N+ και B = H. Παράγεται υδροξείδιο του (2-υδροξυλαιθυλο)τριαλκυλαμμωνίου:
Εφαρμογές οξιρανίου
[επεξεργασία]Η κυριότερη χρήση του οξιρανίου είναι η παραγωγή της αιθυλενογλυκόλης. Χρησιμοποιείται επίσης στην παραγωγή αιθυλενογλυκολικών αιθέρων, καθώς επίσης και στην παρασκευή αιθανολαμινών. Οι αιθανολαμίνες χρησιμοποιούνται στην παραγωγή μη ιονικών απορρυπαντικών και υφάνσιμων ινών.
Το οξιράνιο αυτοπολυμερίζεται κατά την παραμονή προς πολυαιθυλενοξείδιο. Το πολυαιθυλενοξείδιο προστίθεται στους πυροσβεστήρες νερού, έτσι ώστε να αυξάνεται η απόσταση εξακοντισμού του νερού.
Το οξιράνιο χρησιμοποιείται επίσης ως απολυμαντικό στα νοσοκομεία και γενικότερα για την αποστείρωση ιατρικών εργαλείων και εξοπλισμού, ως βακτηριοκτόνο και ως παρασιτοκτόνο στη Γεωπονία.
Κίνδυνοι για την υγεία από την έκθεση σε οξιράνιο
[επεξεργασία]Παρά τη μεγάλη του χρησιμότητα, το αιθυλενοξείδιο είναι τοξικό και εύφλεκτο και έχει συνδεθεί με κάποια σοβαρά ατυχήματα.
Πέραν του ερεθισμού του αναπνευστικού συστήματος και των οφθαλμών, η έκθεση στο αιθυλενοξείδιο μπορεί να προκαλέσει δύσπνοια, θολότητα στην όραση, ναυτία, ζάλη και πονοκεφάλους. Προκαλεί επίσης καρκίνο στα ζώα και τους ανθρώπους. Για την προστασία των εργαζομένων, στις ΗΠΑ ορίζεται ως αποδεκτό όριο έκθεσης το 1 ppm αιθυλενοξειδίου στον αέρα ως μέσο όρο μετρήσεων κατά τη διάρκεια του οκταώρου.
Μεγάλη προσοχή συνιστάται και λόγω της ευφλεκτότητας του αιθυλενοξειδίου. Σε καμία περίπτωση δεν πρέπει η θερμοκρασία του να ξεπεράσει τους 560 °C, καθώς θα αυταναφλεγεί, ακόμη και απουσία οξυγόνου.
Το οξιρένιο και παράγωγα του
[επεξεργασία]
Το εποξυαιθένιο ή οξιρένιο ή οξακυκλοπροπένιο είναι μια υποθετική[1] ετεροκυκλική ένωση με τριμελή δακτύλιο, στον οποίο ένα άτομο οξυγόνου συνδέεται με τα δύο άτομα άνθρακα συνδεμένα με διπλό δεσμό. Δεν έχει ξεκαθαρισθεί αν μπορεί να σταθεί σαν ξεχωριστή ένωση ή πρόκειται μόνο για μια ασταθή μεταβατική κατάσταση που μπορεί να διατηρηθεί μόνο για κλάσματα δευτερολέπτου. Για την ώρα, η υπόσταση της ένωσης βρίσκεται κυρίως σε τεχνικές υπολογιστικών μοντέλων. Υπάρχουν, όμως, κάποιες πειραματικές ενδείξεις ύπαρξης της ένωσης τουλάχιστον ως ενδιάμεση ή μετσβατική κατάσταση που σχηματίζεται, προσωρινά, κατά την ανακατάταξη Wolff. Ακόμη, έχουν πραγματικά απομονωθεί ορισμένα αλκυλιωμένα παράγωγά του. Με βάση το χημικό του τύπο, C2H2O, είναι «τυπικός» υδατάνθρακας (δηλαδή έχει την αναλογία ατόμων υδρογόνου - οξυγόνου 2:1, που έχει και το νερό, αλλά χωρίς να είναι πραγματικό σάκχαρο) και έχει τα ακόλουθα δύο (2) ισομερή:
- Αιθινόλη (ελάσσων ταυτομερές της κετένης) με σύντομο συντακτικό τύπο HC ≡ COH.
- Κετένη (κύριο ταυτομερές της αιθινόλης) με σύντομο συντακτικό τύπο CH2=C=O.
Υποκατεστημένα παράγωγα του οξιρενίου
[επεξεργασία]Αν και είναι αμφίβολη η ύπσρξη του ίδιου του οξιρενίου, είναι βεβαιωμένη η ύπαρξη αρκετών υποκατεστημένων παραγώγων του, δηλαδή ενώσεων που προκύπτουν θεωρητικά από την αντικατάσταση ατόμων υδρογόνου του οξιρενίου από αλκύλια ή και άλλες οργανικές ή και ανόργανες ρίζες, που παράγονται γενικά με καταλυτική οξυγόνωση αλκινίων ή και άλλων παραγώγων με τριπλό δεσμό.
Σημειώσεις
[επεξεργασία]- ↑ Προβλέπεται η ύπαρξή της θεωρητικά, αλλά δεν έχει αναφερθεί παρασκευή ή απομόνωσή της.













![{\displaystyle \mathrm {CH_{2}=CH_{2}+{\frac {1}{2}}O_{2}{\xrightarrow[{1-2MPa,\;280^{o}C}]{Ag}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/a228dd326e455b1702fc6d906bf9e1bdb3ff27d9)























![{\displaystyle \mathrm {+R_{3}N+H_{2}O{\xrightarrow {}}[R_{3}NCH_{2}CH_{2}OH]^{+}OH^{-}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/99d6c20484b314571f7941c40f714d74c9b57bb6)