Οργανική Χημεία/Υδρογονάνθρακες/Αλκάνια

Τα αλκάνια είναι κορεσμένοι αλειφατικοί (δηλαδή μη κυκλικοί) υδρογονάνθρακες και οι πιο απλές οργανικές ενώσεις. Ο χημικός τύπος των ενώσεων της ομόλογης σειράς των κορεσμένων υδρογονανθράκων ανάλογα με τον αριθμό των ατόμων άνθρακα (n) που περιέχουν δίνεται από τον γενικό τύπο: CnH2n+2.
- Παλαιότερα, πριν την επιβολή της ονοματολογίας της Γενεύης, τα αλκάνια και οι άλλοι κορεσμένοι υδρογονάνθρακες ονομάστηκαν παραφίνες εκ των λατινικών λέξεων "parun" (= ολίγον) και "affinas" (= συγγένεια) και αυτό λόγω της χαρακτηριστικής τους χημικής σταθερότητας και αδράνειας που παρουσιάζουν έναντι των περισσοτέρων αντιδραστηρίων.
| Μερικά αέρια αλκάνια | μεθάνιο • αιθάνιο • προπάνιο • βουτάνιο • ισοβουτάνιο • νεοπεντάνιο |
| Μερικά υγρά αλκάνια | πεντάνιο • ισοπεντάνιο • εξάνιο • ισοεξάνιο • 3-μεθυλοπεντάνιο • νεοεξάνιο • 2,3-διμεθυλοβουτάνιο • επτάνιο |
| Μερικά στερεά αλκάνια | δεκαπεντάνιο |
Τα αλκάνια θεωρούνται κορεσμένες ενώσεις (και μάλιστα πλήρως, με βαθμό ακορεστότητας = 0) με την έννοια ότι έχουν αρκετά άτομα υδρογόνου για να ενωθούν με όλα ελεύθερα ηλεκτρόνια των ατόμων του άνθρακα. Οι ενώσεις αυτές ονομάζονται παραφίνες λόγω των πολύ συνεκτικών και σταθερών δεσμών τους και την συνακόλουθη σχετικά μικρή χημική δραστικότητά τους.
- Αν από μόριο αλκανίου αφαιρεθεί ένα άτομο υδρογόνου προκύπτει η ρίζα του αλκυλίου με γενικό τύπο CnH2(n+1) ή συνοπτικά: R-.
- Οι κορεσμένοι υδρογονάνθρακες στους οποίους τα άτομα άνθρακα σχηματίζουν δακτύλιο ονομάζονται κυκλοαλκάνια και έχουν γενικό τύπο CnH2n. Πρόκειται για άλλη ομόλογη σειρά με βαθμό ακορεστότητας 1, ισομερή προς τα αλκένια.
Αλκάνια που διατηρούν και εμπειρικές ονομασίες
[επεξεργασία]- Ισοβουτάνιο ή μεθυλοπροπάνιο.
- Ισοπεντάνιο ή μεθυλοβουτάνιο.
- Νεοπεντάνιο ή διμεθυλοπροπάνιο.
- Ισοεξάνιο ή 2-μεθυλοπεντάνιο.
- Νεοεξάνιο ή 2,2-διμεθυλοβουτάνιο.
- Ισοοκτάνιο ή 2,2,4-τριμεθυλοπεντάνιο.
Αναπαράσταση αλκανίων
[επεξεργασία]Όταν αποδίδουμε τη δομή ενός αλκανίου, μπορείτε να δείτε διαφορετικά επίπεδα σχεδίασης, που εξαρτώνται από τις επιθυμητές λεπτομέρειες και το διαθέσιμο χώρο και χρόνο. Για παράδειγμα, το πεντάνιο, με χημικό τύπο C5H12, μπορεί να αναπαρασταθεί με τους ακόλουθους τρόπους:
Ονοματολογία
[επεξεργασία]Τα πρώτα τέσσερα μέλη της σειράς των αλκανίων ονομάζονται αντίστοιχα μεθάνιο, αιθάνιο, προπάνιο και βουτάνιο. Των υπολοίπων, χωρίς διακλαδώσεις στην ανθρακική αλυσίδα, η ονομασία της ρίζας τους λαμβάνεται διεθνώς εκ των ελληνικών αριθμητικών, (π.χ. πεντά-, εξά-), ανάλογα του αριθμού των ατόμων άνθρακα που περιέχουν και την κατάληξη -άνιο. Έτσι, έχουμε για παράδειγμα τις παρακάτω ενώσεις ανάλογα με το αριθμό ατόμων άνθρακα, n.
| n | n | n | |||
| 1 | μεθάνιο | 4 | βουτάνιο | 19 | δεκαεννεάνιο |
| 2 | αιθάνιο | 5 | πεντάνιο | 30 | τριακοντάνιο |
| 3 | προπάνιο | 10 | δεκάνιο | 70 | εβδομηκοντάνιο |
Οι μονοσθενείς ρίζες, που προκύπτουν από τα αλκάνια με αφαίρεση ενός ατόμου υδρογόνου από ακραίο άτομο άνθρακα, ονομάζονται όπως τα αντίστοιχα αλκάνια με αντικατάσταση της καταλήξεως «-άνιο» από την κατάληξη «-υλο-». Η αρίθμηση της ανθρακικής αλυσίδας αρχίζει από τον άνθρακα με το ελεύθερο σθένος. Π.χ. μεθύλιο: CH3- , αιθύλιο: CH3CH2-, πεντύλιο: CH3CH2CH2CH2CH2-, κ.τ.λ..
Οι δισθενείς ρίζες, που προκύπτουν από τα αλκάνια με αφαίρεση ατόμων υδρογόνου από δύο ακραία άτομα άνθρακα, ονομάζονται «-υλενο-», προπυλενο-, βουτυλενο-, κ.ο.κ., ανάλογα με τον αριθμό ατόμων άνθρακα. Π.χ. αιθυλενο-: -CH2CH2- , προπυλενο-: -CH2CH2CH2-, κ.τ.λ..
Οι επόμενοι κανόνες κατά IUPAC εφαρμόζονται για την απόδοση ονομάτων σε αλκάνια με διακλαδισμένες αλυσίδες:
- Προσδιορίζεται η μακρύτερη συνεχόμενη (όχι υποχρεωτικά ευθεία) αλυσίδα ατόμων άνθρακα στο μόριο. Το κύριο όνομα του αλκανίου διακλαδισμένης αλυσίδας είναι το όνομα του αλκανίου ευθύγραμμης αλυσίδας, το οποίο αντιστοιχεί στον αριθμό ατόμων άνθρακα αυτής της μακρύτερης αλυσίδας. Το πλήρες όνομα του αλκανίου περιλαμβάνει και το όνομα κάθε διακλαδισμένης αλυσίδας. Τα ονόματα αυτά τοποθετούνται μπροστά από το κύριο όνομα, όπως περιγράφουν οι επόμενοι κανόνες.
- Κάθε αλυσίδα που εμφανίζεται ως διακλάδωση της μακρύτερης αλυσίδας παίρνει το όνομα μια αλκυλομάδας, δηλαδή της μονοσθενούς ρίζας του αντίστοιχου αλκανίου η οποία ονοματίζεται όπως περιγράφεται παραπάνω.
- Το πλήρες όνομα της διακλάδωσης απαιτεί έναν αριθμό θέσης, ο οποίος εντοπίζει τη διακλάδωση πάνω στη μακρύτερη αλυσίδα. Για το σκοπό αυτό, αριθμείται κάθε άτομο άνθρακα της μακρύτερης αλυσίδας προς την κατεύθυνση που δίνει τους μικρότερους αριθμούς εντοπισμού (το μικρότερο άθροισμα αριθμών όταν είναι περισσότερες από μία) όλων των διακλαδώσεων.[1].
- Όταν υπάρχουν περισσότερες από μία διακλαδώσεις αλκυλίων του ίδιο είδους, ο αριθμός τους υποδηλώνεται από ένα πρόθεμα, όπως δι-, τρι- ή τετρα-, το οποίο συνοδεύει το όνομα της διακλάδωσης. Η θέση κάθε ομάδας πάνω στη μακρύτερη αλυσίδα δίνεται από αριθμούς. Οι αριθμοί που υποδηλώνουν τη θέση διαχωρίζονται με κόμμα και ακολουθούνται από μία παύλα. Όταν υπάρχουν δύο ή περισσότερες διαφορετικές διακλαδώσεις αλκυλίων, το όνομα κάθε διακλάδωσης, μαζί με τον αριθμό θέσης προηγείται του βασικού ονόματος. Τα ονόματα των αλυσίδων τοποθετούνται είτε με αλφαβητική σειρά είτε με βάση την απλότητα των πλευρικών αλυσίδων.
- Οι παραπάνω κανόνες παραβιάζονται μερικές φορές για λόγους απλοποίησης του τελικού ονόματος. Η πιο συνηθισμένη παραβίαση είναι του 1ου κανόνα, δηλαδή η επιλογή όχι της μακρύτερης αλυσίδας, αλλά της πιο πολύπλοκης (δηλ. αυτή με τους περισσότερες ή πολυπλοκότερες διακλαδώσεις), για να αποφευχθεί η ανάγκη αναγραφής μεγάλου αριθμού διακλαδώσεων.
Π.χ.:
Ισομέρεια
[επεξεργασία]Τα αλκάνια στα οποία τα άτομα άνθρακα είναι ενωμένα μεταξύ τους έτσι ώστε να δίνουν μία ευθεία αλυσίδα, ονομάζονται κανονικά αλκάνια και αυτό συμβολίζεται με το πρόθεμα n- (ή κ- σε μέρος της ελληνικής βιβλιογραφίας), π.χ. n-βουτάνιο ή κ-βουτάνιο. Εκτός από τα αλκάνια ευθείας αλυσίδας, υπάρχουν και αλκάνια διακλαδισμένης αλυσίδας. Σε αυτά τα μόρια, ένα ή περισσότερα από τα υδρογόνα έχουν αντικατασταθεί από αλκύλια και έτσι προκύπτουν ισομερείς ενώσεις των κανονικών αλκανίων. Ο γενικός τους τύπος παραμένει ο ίδιος, αλλά η συντακτική τους δομή παρουσιάζεται πιο συμπαγής λόγω των διακλαδώσεων.
Κάθε αλκάνιο με n>3 (δηλαδή μετά το προπάνιο) έχει ένα ορισμένο αριθμό ισομερών που αυξάνεται γεωμετρικά με των αριθμό ατόμων άνθρακα που περιέχει:
| Αριθμός ατόμων C | Αριθμός ισομερών |
| 1 | 1 |
| 2 | 1 |
| 3 | 1 |
| 4 | 2 |
| 5 | 3 |
| 6 | 5 |
| 7 | 9 |
| 8 | 17 |
| ... | ... |
| 12 | 355 |
| ... | ... |
| 32 | 27.711.253.769 |
| ... | ... |
| 60 | 22.158.734.535.770.411.074.184 |
| ... | ... |
Επειδή τα ισομερή αυτά έχουν διαφορετικές δομές έχουν και διαφορετικές ιδιότητες όπως φαίνεται π.χ. στον πίνακα με τα ισομερή του πεντανίου:
| Συντακτικός τύπος Δομή |
Όνομα IUPAC (ελληνική μορφή) Όνομα |
Μοριακό βάρος |
Σημείο ζέσεως (°C, 1 atm) |
Κρίσιμη πίεση (atm) |
Κρίσιμη θερμοκρασία (°C) |
  |
κ-πεντάνιο πεντάνιο |
72,149 | 36,06 | 33,25 | 196,50 |
  |
2-μεθυλοβουτάνιο ισοπεντάνιο |
72,149 | 27,84 | 33,37 | 187,24 |
  |
2,2-διμεθυλοπροπάνιο νεοπεντάνιο |
72,149 | 9,50 | 31,57 | 160,60 |
Μοριακή γεωμετρία
[επεξεργασία]
Το άτομο του άνθρακα στη θεμελιώδη του κατάσταση εμφανίζει μία ηλεκτρονική διαμόρφωση με τρία 2p τροχιακά και ένα 2s τροχιακό. Με βάση την ηλεκτρονική θεωρία του σθένους, κατά την οποία το αριθμητικό σθένος εξισώνεται με τον αριθμό των μονήρων ηλεκτρονίων σθένους, το άτομο του άνθρακα θα έπρεπε να εμφανίζεται ως δισθενές και όχι τετρασθενές. Για να εξηγήσει λοιπόν την τετρασθένειά του και την ισοτιμία των τεσσάρων σθενών, ο Αμερικανός χημικός Linus Pauling διατύπωσε τη θεωρία του υβριδισμού των ατομικών τροχιακών.
Σύμφωνα με τη θεωρία αυτή, η εξίσωση του αριθμητικού σθένους με τον αριθμό των μονήρων ηλεκτρονίων εξηγείται με την παραδοχή ότι ένα ηλεκτρόνιο από την 2s τροχιά ανυψώνεται στην κενή 2pz τροχιά. Τα τέσσερα τροχιακά που δημιουργούνται με αυτόν τον τρόπο υβριδοποιούνται, οπότε δημιουργούνται τέσσερα ισότιμα υβριδοποιημένα τροχιακά που συμβολίζονται ως sp3. Οι δεσμοί που δημιουργούνται είναι ισότιμοι, ονομάζονται σ δεσμοί και έχουν τετραεδρική διάταξη με γωνία μεταξύ των δεσμών 109° 28'.
Προέλευση
[επεξεργασία]Τα αλκάνια απαντώνται τόσο στη Γη όσο και στο ηλιακό μας σύστημα, αλλά συνήθως μόνο τα περίπου εκατό πρώτα μέλη της ομόλογης σειράς και κυρίως σε ίχνη. Οι ελαφροί υδρογονάνθρακες, και κυρίως το μεθάνιο και το αιθάνιο, έχουν εντοπιστεί σε ουρές κομητών αλλά και σε μετεωρίτες. Επίσης, αποτελούν ένα σημαντικό ποσοστό της ατμόσφαιρας των αέριων πλανητών Δία, Κρόνου, Ουρανού και Ποσειδώνα. Στον Τιτάνα, δορυφόρο του Κρόνου, πιστεύεται ότι κάποτε υπήρχαν μεγάλοι ωκεανοί μικρών ή και μακρύτερων αλκανίων ενώ τώρα πιστεύεται ότι υπάρχουν μικρότερες θάλασσες υγρού αιθανίου.
Στη Γη οι κύριες πηγές των υδρογονανθράκων είναι τα ορυκτά καύσιμα (φυσικό αέριο, πετρέλαιο και γαιάνθρακες. Το φυσικό αέριο είναι κατά βάση μεθάνιο με μικρότερες ποσότητες άλλων αέριων αλκανίων (αιθάνιο, προπάνιο, βουτάνιο), καθώς και ποσότητες διυδρογόνου και ηλίου. Το πετρέλαιο είναι μείγμα αλκανίων και κυκλοαλκανίων με μικρότερες ποσότητες αρωματικών υδρογονανθράκων, αλλά και άλλων (κυρίως θειούχων) οργανικών ενώσεων (δηλαδή και άλλων κατηγοριών υδρογονανθράκων και μη υδρογονανθράκων). Η δημιουργία των ορυκτών αυτών σχετίζεται με την δημιουργία ιζηματογενών πετρωμάτων και αποτελεί προϊόν αποδόμησης των ζωικών και φυτικών ιστών οι οποίοι παγιδεύτηκαν μέσα στα πετρώματα στη διάρκεια της δημιουργίας τους. Η διεργασία αυτή έλαβε χώρα στη διάρκεια εκατομμυρίων ετών. Αρχικά μία ποσότητα του οργανικού υλικού υπό την επίδραση αερόβιων μικροοργανισμών μετατράπηκε σε αέριο το οποίο και απελευθερώθηκε, ενώ απομακρύνθηκε το υδατοδιαλυτό μέρος του υλικού. Το υπόλειμμα δεν αποδομήθηκε λόγω έλλειψης οξυγόνου. Υπό την επίδραση αναερόβιων μικροοργανισμών τα μεγάλα οργανικά μόρια διασπάστηκαν δίδοντας συστατικά πλούσια σε άνθρακα και υδρογόνο. Η αυξημένη πίεση από το βάρος των υπερκειμένων στρωμάτων του πετρώματος και η υψηλή θερμοκρασία ολοκληρώνουν την μετατροπή της οργανικής ύλης σε πετρέλαιο. Τα αρχαιότερα κοιτάσματα χρονολογούνται στα 600 εκατομμύρια χρόνια και τα νεότερα σε 1 εκατομμύριο χρόνια.
Παραγωγή
[επεξεργασία]Βιομηχανικό ενδιαφέρον συνθετικής παρασκευής αλκανίων δεν υπάρχει ακόμη, διότι όλες οι ανάγκες καλύπτονται άμεσα ή έμμεσα από φυσικές πηγές. Η γνώση όμως των μεθόδων συνθετικής παρασκευής αλκανίων παρουσιάζει ενδιαφέρον για την Συνθετική Οργανική Χημεία, εφόσον ουσιαστικά πρόκειται για μεθόδους παραγωγής δεσμών C-C ή C-H, τα μόνα είδη δεσμών που περιέχουν τα αλκάνια. Έτσι, οι σπουδαιότεροι τρόποι παραγωγής αλκανίων είναι οι ακόλουθοι[2]:
Ανοικοδόμηση: σύνθεση μεγαλύτερης ανθρακικής αλυσίδας από μικρότερες
[επεξεργασία]Μέθοδος Würtz
[επεξεργασία]Κατά την επίδραση νατρίου (Na) σε αλκυλαλογονίδια (RX) σχηματίζονται «συμμετρικά» αλκάνια[3]:
- Αν το αλκύλιο είναι τριτοταγές (δηλαδή το άτομο άνθρακα με ελεύθερο ηλεκτρόνιο είναι ενωμένο με άλλα τρία άτομα άνθρακα) η παραπάνω αντίδραση δεν πραγματοποιείται, λόγω στερεοχημικής παρεμπόδισης.
- Αν και στην κλασσική αντίδραση που χρησιμοποίησε ο Würtz χρησιμοποίησε νάτριο, αργότερα αποδείχθηκε ότι μπορούν να χρησιμοποιηθούν για ανάλογη αντίδραση επίσης τα ακόλουθα μέταλλα: Κάλιο (K), μαγνήσιο (Mg) και ψευδάργυρος (Zn).
- Αν χρησιμοποιηθούν δυο διαφορετικά αλκυλαλογονίδια παράγονται μίγματα των δυο συμμετρικών και ενός μη συμμετρικού:
- Η αντίδραση χρησιμοποιείται όταν τα διαφορετικά αλκάνια που παράγονται έχουν σημεία ζέσης με (σχετικά) μεγάλη διαφορά, γιατί τότε είναι σχετικά εύκολος ο διαχωρισμός τους με κλασματική απόσταξη.
Με οργανομεταλλικές ενώσεις
[επεξεργασία]1. Με Li (σύνθεση κατά Corey-House)[4]:
2. Με Mg[5]:
Ηλεκτρολυτική μέθοδος Kolbé
[επεξεργασία]Κατά την ηλεκτρόλυση διαλυμάτων αλάτων καρβονικών οξέων με αλκάλια σχηματίζονται στην άνοδο «συμμετρικά» αλκάνια. Για την αντίδραση Kolbé έχουν προταθεί διάφοροι μηχανισμοί, με επικρατέστερο των μηχανισμό ελεύθερων ριζών[6]:
- Το μειονέκτημα και αυτής της μεθόδου είναι ο σχηματισμός παραπροϊόντων, ακόμη και αν χρησιμοποιηθεί άλας ενός καρβονικού οξέος, γιατί συμπαράγονται παραπροϊόντα μεταθέσεων.
Παρεμβολή καρβένίου σε άλλα αλκάνια
[επεξεργασία]Παράδειγμα παρεμβολής μεθυλενίου[7]:
- Το μειονέκτημα αυτής της μεθόδου είναι ο σχηματισμός όλων των πιθανών ισομερών, γιατί όλοι οι δεσμοί C-H έχουν πρακτικά ίσες πιθανότητες παρεμβολής από το εξαιρετικά ασταθές και δραστικό καρβένιο (που λειτουργεί πρακτικά σαν ελεύθερη δίριζα) που παράγεται ενδιάμεσα.
Χωρίς μεταβολή της ανθρακικής αλυσίδας
[επεξεργασία]Αναγωγή αλογονούχων ενώσεων
[επεξεργασία]Σ' αυτή τη μέθοδο χρησιμοποιούνται διάφορα αναγωγικά μέσα, η εκλογή του οποίου εξαρτάται κυρίως από τη φύση του αλκυλαλογονιδίου (πρωτοταγές, δευτεροταγές, τριτοταγές, καθώς και του αλογόνου του). 1. Αναγωγή με «υδρογόνο εν τω γεννάσθαι» (μέταλλο + οξύ). Π.χ.[8]:
2. Αναγωγή με LiAlH4 ή NaBH4. Π.χ.[9]:
ή ομοίως:
3. Αναγωγή αλκυλιωδιδίων με HI. Π.χ.[10]:
4. Αναγωγή μέσω οργανομαγνησιακών ενώσεων[11]:
5. Αναγωγή από ένα αλκανοκασσιτεράνιο. Π.χ.[12]:
6. Με αναγωγή αλκυλαλογονιδίου από σιλάνιο, παρουσία τριφθοριούχου βορίου παράγεται αλκάνιo[13]:
Καταλυτική υδρογόνωση ακόρεστων αλειφατικών υδρογονανθράκων, κυκλοπροπανίων ή και κυκλοβουτανίων
[επεξεργασία]Η υδρογόνωση ακόρεστων υδρογονανθράκων οδηγεί σε αλκάνια, των οποίων οι αποδόσεις προσεγγίζουν το 100%, συνήθως παρουσία καταλυτών όπως Pt, Pd και Ni. Π.χ.:
Αναγωγή οξυγονούχων ενώσεων
[επεξεργασία]1. Η αναγωγή των αλδεΰδης, σύμφωνα με την αντίδραση Wolf-Kishner πραγματοποιείται με αλκαλικό διάλυμα υδραζίνης[14]:
2. Η αναγωγή των κετόνης, σύμφωνα με την αντίδραση Clemmensen, πραγματοποιείται με επίδραση ψευδαργύρου και υδροχλωρικού οξέος[15]:
Αναγωγή θειούχων ενώσεων
[επεξεργασία]1. Με αναγωγή των κατάλληλων θειολών μπορεί να παραχθεί αλκάνιο (μέθοδος Raney)[16]:
2. Με αναγωγή των κατάλληλων θειεστέρων μπορεί να παραχθεί αλκάνιο (μέθοδος Raney). [17]:
Αποικοδόμηση: αποσύνθεση μεγαλύτερης αλυσίδας σε μικρότερη
[επεξεργασία]Κατά τη θέρμανση αλάτων καρβονικών οξέων με καυστικά αλκάλια σχηματίζονται αλκάνια. Π.χ.[18]:
Φυσικές ιδιότητες
[επεξεργασία]
Τα μέλη της ομόλογης σειράς των αλκανίων έχουν φυσικές ιδιότητες οι οποίες μεταβάλλονται κατά μήκος της σειράς με κανονικό τρόπο. Έτσι υπό κανονικές συνθήκες, τα πρώτα μέλη της σειράς από 1 έως 4 άτομα άνθρακα είναι αέρια, τα μέσα μέλη άνω του βουτανίου είναι υγρά και τα ανώτερα αλκάνια, άνω του δεκαπεντανίου, είναι στερεά. Σε γενικές γραμμές για κάθε μεθυλενική ομάδα που προστίθεται το σημείο ζέσεως αυξάνεται από 20 έως 30 °C, όπως φαίνεται και στο διπλανό διάγραμμα. Από την άλλη, το σημείο τήξης των κανονικών αλκανίων, παρόλο που αυξάνεται επίσης με την αύξηση των ατόμων άνθρακα (με την εξαίρεση του προπανίου), αυξάνεται εμφανώς πιο αργά ιδιαίτερα στα ανώτερα αλκάνια. Επίσης, το σημείο τήξης των αλκανίων με περιττό αριθμό ατόμων άνθρακα αυξάνεται γρηγορότερα από το σημείο τήξης των αλκανίων με ζυγό αριθμό ατόμων άνθρακα.
Γενικά, τα γραμμικά αλκάνια έχουν υψηλότερο σημείο ζέσεως από τα αντίστοιχα διακλαδισμένα. Αυτό αποδίδεται στις δυνάμεις van der Waals που ασκούνται εντονότερα μεταξύ των μορίων γραμμικών αλκανίων από ότι μεταξύ των μορίων διακλαδισμένων αλκανίων. Στα διακλαδισμένα αλκάνια, τα οποία έχουν περισσότερο σφαιρικό σχήμα από τα γραμμικά και άρα μικρότερη εξωτερική επιφάνεια, η επαφή μεταξύ των μορίων είναι μικρότερη και επομένως μεταξύ των μορίων ασκούνται ασθενέστερες δυνάμεις van der Waals.
Τα αλκάνια θεωρούνται άπολες ενώσεις και γι' αυτό δεν σχηματίζουν δεσμούς υδρογόνου και δεν διαλύονται σε πολικούς διαλύτες όπως το νερ] και οι αλκοόλες. Αντίθετα, διαλύονται εύκολα σε άπολους διαλύτες όπως το βενζόλιο και ο τετραχλωράνθρακας. Τέλος, διάφορα αλκάνια μπορούν αναμειχθούν μεταξύ τους σε διάφορες αναλογίες.
Η πυκνότητα των αλκανίων αυξάνεται με την αύξηση του αριθμού των ατόμων άνθρακα αλλά παραμένει μικρότερη από αυτή του νερού. Έτσι, σε ένα μείγμα νερού-αλκανίων τα αλκάνια διατηρούνται πάντα στα ανώτερα στρώματα του μίγματος.
Φασματοσκοπικές ιδιότητες
[επεξεργασία]Ουσιαστικά όλες οι οργανικές ενώσεις περιέχουν δεσμούς άνθρακα-άνθρακα και άνθρακα-υδρογόνου, και έτσι παρουσιάζουν κάποια από τα χαρακτηριστικά των αλκανίων στο φάσμα τους. Αντίθετα, τα αλκάνια χαρακτηρίζονται από την απουσία άλλων χαρακτηριστικών ομάδων εκτός από τις παραπάνω με αποτέλεσμα την απουσία στο φάσμα των αντίστοιχων χαρακτηριστικών απορροφήσεων. Γι' αυτό τον λόγο τα αλκάνια είναι πολύ καλοί διαλύτες άλλων ουσιών ιδιαίτερα για την μελέτη των τελευταίων με φασματοσκοπία υπεριώδους-ορατού.
Στη φασματοσκοπία υπερύθρου (IR) η δόνηση τάσεως του δεσμού άνθρακα-υδρογόνου εμφανίζεται ισχυρή μεταξύ 2850 και 2950 cm-1, ενώ η αντίστοιχη του δεσμού άνθρακα-άνθρακα εμφανίζεται μεταξύ 700 και 1300 cm-1. Η δόνηση κάμψεως του δεσμού άνθρακα-υδρογόνου εξαρτάται από το είδος της ομάδας. Έτσι, στις μεθυλο-ομάδες εμφανίζεται στα 1430 – 1470 cm-1 και στα 1370 – 1380 cm-1, ενώ στις μεθυλενο-ομάδες στα 1445 – 1485 cm-1. Τέλος, αλκάνια με περισσότερα από τέσσερα άτομα άνθρακα παρουσιάζουν μία ασθενή απορρόφηση στα 720 – 750 cm-1.
Στη φασματοσκοπία πρωτονιακού πυρηνικού μαγνητικού συντονισμού (H-NMR) των αλκανίων είναι πολύ χαρακτηριστικά. Τα πρωτόνια των μέθυλο-ομάδων συντονίζονται περίπου στα 0,9 ppm, ενώ των μεθυλενο-ομάδων στα 1,25 ppm περίπου. Διάκριση μεταξύ γραμμικού και διακλαδισμένου αλκανίου μπορεί να γίνει με συγκριτική μελέτη της εμβαδομετρήσεως των κορυφών των μεθυλο- και μεθυλενο- ομάδων.
Η φασματοσκοπία μαζών αποτελεί μια πρώτης τάξεως μέθοδο για τη μελέτη της δομής είτε καθαρών είτε μιγμάτων αλκανίων. Αλκάνια με ευθεία αλυσίδα δίνουν φάσματα μαζών, χαρακτηριστικό των οποίων είναι η ύπαρξη ομάδων κορυφών που απέχουν κατά 14 μονάδες μάζας (-CH2-). Κάθε ομάδα αποτελείται από τρεις επιμέρους κορυφές που αντιστοιχούν στα CnH2n+1 (περισσότερο έντονη), CnH2n και CnH2n-1. Χαρακτηριστικό των διακλαδισμένων αλκανίων είναι το θραύσμα που αντιστοιχεί στο σημείο της διακλαδώσεως και εμφανίζεται με μεγαλύτερη ένταση.
Χημικές ιδιότητες και παράγωγα
[επεξεργασία]Τα αλκάνια έχουν γενικά μικρή δραστικότητα, διότι οι δεσμοί άνθρακα – άνθρακα και άνθρακα – υδρογόνου είναι σχετικά σταθεροί και τα μόρια των αλκανίων δεν διαθέτουν άλλες χαρακτηριστικές ομάδες.
Παρόλα αυτά, ορισμένες αντιδράσεις των αλκανίων έχουν εξαιρετική σπουδαιότητα τόσο στη διύλιση του πετρελαίου όσο και γενικότερα στην οργανική χημική βιομηχανία και χρησιμοποιούνται περισσότερο από κάθε άλλη αντίδραση, κυρίως εξαιτίας της σχετικά μεγάλης και εύκολης διαθεσιμότητας που έχουν ως πρώτες ύλες, άμεσα ή έμμεσα, λόγω της παγκόσμιας μαζικής χρήσης των ορυκτών κοιτασμάτων υδρογονανθράκων του πλανήτη. Άλλωστε η σχετικά μεγάλη απλότητά τους κάνει εφικτή και σχετικά οικονομική και την τεχνητή σύνθεσή τους.
Οξείδωση
[επεξεργασία]1. Όλα τα αλκάνια πάνω από μια ορισμένη θερμοκρασία, με περίσσεια οξυγόνου οξειδώνονται τόσο γρήγορα προς διοξείδιο του άνθρακα και νερό, ώστε να λέμε ότι καίγονται. Η γενική εξίσωση της πλήρους καύσης των αλκανίων έχει την παρακάτω μορφή[19]:
2. Επίσης, τα αλκάνια σε σύγκριση με πολλές άλλες τάξεις οργανικών ενώσεων, είναι αρκετά ανθεκτικά στην επίδραση συνηθισμένων οξειδωτικών μέσων. Έτσι, στη συνηθισμένη θερμοκρασία, το υπερμαγγανικό ή το διχρωμικό κάλιο προσβάλουν αρκετά αργά τα αλκάνια. Παρόλα αυτά, αλκάνια με τριτοταγές άτομο άνθρακα (παράδειγμα ισοβουτάνιο) στη συνηθισμένη θερμοκρασία οξειδώνονται σχετικά εύκολα με υπερμαγγανικό κάλιο. Π.χ.:
3. Επίσης πολλά δίνουν αντιδράσεις καταλυτικής μερικής οξείδωσης. Π.χ.:
Αλογόνωση
[επεξεργασία]Η δραστικότητα των αλογόνων ακολουθεί την εξής σειρά: φθόριο >> χλώριο > βρώμιο >> ιώδιο. Έτσι, η απευθείας φθορίωση των αλκανίων γίνεται συνήθως βίαια και συχνά με έκρηξη. Γι' αυτό τον λόγο συνήθως εφαρμόζονται ειδικές μέθοδοι για την παραγωγή φθοροπαραγώγων. Η αντίδραση με χλώριο είναι σχετικά γρήγορη, με βρώμιο πιο αργή, απαιτεί σημαντική ποσότητα υπεριώδους ακτινοβολίας και είναι πιο εκλεκτική, ενώ με ιώδιο είναι εξαιρετικά βραδεία και ενεργοβόρα, οπότε και για τα ιωδοπαράγωγα συνήθως εφαρμόζονται ειδικές μέθοδοι για την παραγωγή τους.
Τα άτομα υδρογόνου των αλκανίων μπορούν να αντικατασταθούν από χλώριο ή βρώμιο δια μέσου μια αλυσωτής αντιδράσεως ελευθέρων ριζών, ο μηχανισμός της οποίας μπορεί να συνοψισθεί ως εξής:
1. Έναρξη: Ένα μόριο αλογόνου διασπάται σε δύο ελεύθερες ρίζες με τη βοήθεια υπεριώδους ακτινοβολίας ή θέρμανσης:
2. Διάδοση: Η ελεύθερη ρίζα του αλογόνου αποσπά ένα άτομο υδρογόνου από το αλκάνιο (RH) και στη συνέχεια η ρίζα αντιδρά με αλογόνο δίνοντας το προϊόν της αλογόνωσης:
3. Τερματισμός: Η αντίδραση ολοκληρώνεται με τους παρακάτω τρεις τρόπους:
Παρεμβολή καρβενίων στους δεσμούς C-H
[επεξεργασία]Τα καρβένια (π.χ. [:CH2]) είναι ασταθείς και γι' αυτό εξαιρετικά δραστικές ενώσεις του CII και μπορούν παρεμβληθούν στους δεσμούς C-H, με δραστικότητα δίριζας. Π.χ. έχουμε[20]:
Νίτρωση
[επεξεργασία]Κατά την κατεργασία αλκανίων με νιτρικό οξύ μπορούν να αντικατασταθούν ένα ή περισσότερα άτομα υδρογόνου από την νιτρο-ομάδα (-ΝΟ2). Η όλη αντίδραση είναι γνωστή ως νίτρωση. Η νίτρωση γίνεται είτε σε αέρια φάση (καταλληλότερη για αλκάνια μικρού μοριακού βάρους), είτε σε υγρή φάση, κατά την οποία αλκάνια μεγάλου μοριακού βάρους θερμαίνονται σε θερμοκρασία 140 °C με πυκνό νιτρικό οξύ υπό πίεση[21]:
Κατά την νίτρωση αλκανίων παράγονται μίγματα νιτροπαραφινών, ο σχηματισμός των οποίων οφείλεται όχι μόνο σε αντικατάσταση ατόμων υδρογόνου από νιτρο-ομάδες, αλλά και σε αντίδραση της νιτρο-ομάδας με οποιαδήποτε αλκυλο-ομάδα που θα μπορούσε να δημιουργηθεί από τη σχάση της αλυσίδας του υδρογονάνθρακα.
Η νίτρωση σε αέρια φάση ακολουθεί τον μηχανισμό ελεύθερων ριζών. Σε αυτή την περίπτωση η ευκολία υποκαταστάσεως υδρογόνου από νιτρο-ομάδα ακολουθεί την παρακάτω σειρά εξαιτίας του ενδιάμεσου σχηματισμού σταθερότερων ριζών: .
Χρήσεις – Εφαρμογές των αλκανίων
[επεξεργασία]Μεθάνιο: αέριο κύριο συστατικό του φυσικού αερίου (καύσιμο) Αιθάνιο: συστατικό του φυσικού αερίου (καύσιμο) Προπάνιο: συστατικό του υγραερίου (LPG), υγραερίου (καύσιμο) Βουτάνιο: συστατικό του υγραερίου (LPG), αναπτήρες (καύσιμο) Πεντάνιο: συστατικό της βενζίνης (καύσιμο) Εξάνιο: συστατικό της βενζίνης (καύσιμο) Επτάνιο: συστατικό της βενζίνης. Οκτάνιο: σημαντικό συστατικό της βενζίνης (καύσιμο). Εννεάνιο: συστατικό της βενζίνης (καύσιμο). Δεκάνιο: συστατικό της βενζίνης (καύσιμο). Δεκαεξάνιο: συστατικό του καυσίμου ντίζελ και του πετρελαίου θέρμανσης.
Τα αλκάνια χρησιμοποιούνται επίσης: -Στην παραγωγή πολυμερών - Χρησιμεύουν ως ενδιάμεσα στη σύνθεση των φαρμάκων, εντομοκτόνων και άλλων πολύτιμων χημικών ουσιών (π.χ. αιθανόλη, οξικό οξύ, αιθυλενογλυκόλη, χλωριούχο βινύλιο). -Παραφίνη (κατασκευή κεριών). -Βαζελίνη -Άσφαλτο, σε όλα τα πλαστικά, ακρυλικά και πλαστικά χρώματα, στα καλλυντικά, στα απορρυπαντικά, στα γκαζάκια, κινητήρες ως καύσιμο αλλά και σε στα μέρη των μηχανών (π.χ. καρμπιρατέρ). -Ως διαλύτης με το όνομα πετρελαϊκός αιθέρας. -Ως λιπαντικά έλαια και με τη μορφή των αλάτων σουλφοξέων με νάτριο στη βιομηχανία των απορρυπαντικών.
Κίνδυνοι για την υγεία
[επεξεργασία]Το μεθάνιο καθώς και άλλα αλκάνια χαμηλού μοριακού βάρους μπορούν να δημιουργήσουν εκρηκτικά μίγματα με τον αέρα (1-8% CH4) ενώ το μεθάνιο θεωρείται δεύτερο σημαντικότερο αέριο του θερμοκηπίου (μετά το CO2). Τα ελαφρά υγρά αλκάνια είναι εξαιρετικά εύφλεκτα αλλά αυτός ο κίνδυνος μειώνεται με την αύξηση του μήκους της ανθρακικής αλυσίδας. Τα πεντάνιο, εξάνιο, επτάνιο και οκτάνιο έχουν επισημανθεί από την Ευρωπαϊκή Ένωση ως επικίνδυνα για το περιβάλλον και επιβλαβή.
Μεθάνιο
[επεξεργασία]
Το μεθάνιο (methane) είναι το απλούστερο αλκάνιο, δηλαδή άκυκλος κορεσμένος υδρογονάνθρακας. Έχει χημικό τύπο CH4. Είναι το κύριο συστατικό του φυσικού αερίου (70-90%). Το μόριό του έχει τη δομή κανονικού τετραέδρου, με το άτομο άνθρακα στο κέντρο και τα τέσσερα (4) άτομα του υδρογόνου στις κορυφές. Οι γωνίες των τεσσάρων δεσμών C-H είναι 109° 28΄ [για την ακρίβεια ισούται με το συν-1(-1/3)]. Στις κανονικές συνθήκες (25°C, 1 atm) είναι αέριο άχρωμο και άοσμο[22], ελάχιστα διαλυτό στο νερό. Διαλύεται ευκολότερα σε οργανικούς διαλύτες. Η ύπαρξή του δεν ανιχνεύεται εύκολα, ενώ με τον αέρα σχηματίζει εκρηκτικά μίγματα. Αυτός είναι ο λόγος που συχνά αναφέρονται εκρήξεις σε ανθρακωρυχεία.
Η τέλεια καύση του αποδίδεται από την ακόλουθη στοιχειομετρική και θερμοδυναμική εξίσωση:
Η σχετικά μεγάλη ενεργειακή απόδοση, η σχετικά καθαρή καύση του και η σχετικά χαμηλή του τιμή το κάνουν ένα πολύ ελκυστικό καύσιμο παραγωγής ηλεκτρικής ενέργειας και οικιακής θέρμανσης. Το γεγονός ότι είναι αέριο και μάλιστα μη υγροποιήσιμο μόνο με συμπίεση (όπως τα υγραέρια προπάνιο (C3H8), βουτάνιο (C4H10), ισοβουτάνιο [(CH3)3CH] και νεοπεντάνιο) [(CH3)4C] το κάνει δύσχρηστο ως καύσιμο οχημάτων. Για τον ίδιο λόγο και η μεταφορά του είναι σχετικά δύσκολη. Χρησιμοποιούνται συχνά ειδικοί αγωγοί για τη μεταφορά του (συνήθως με τη μορφή του φυσικού αερίου) ή ειδικά πλοία (μεταφορικά υγροποιημένου φυσικού αερίου, LNG carriers) που το μεταφέρουν σε υγρή μορφή υπό ψύξη κάτω από την θερμοκρασία ζέσης του (-163 °C), οπότε μπορεί πλέον να υγροποιηθεί το μεθάνιο και τα βαρύτερα συστατικά του φυσικού αερίου[23].
Το μεθάνιο ανακαλύφθηκε και απομονώθηκε από τον Αλεσάντρο Βόλτα κατά τη χρονική περίοδο 1776-1778, όταν μελετούσε το αέριο που εκλύεται από τη λίμνη Ματζόρε.
Το μεθάνιο είναι ένα σχετικά ισχυρό αέριο θερμοκηπίου με το σχετικά μεγάλο δυναμικό παγκόσμιας θέρμανσης 72 (υπολογισμένο σε μέσο όρο 20 ετών) ή 25 (υπολογισμένο σε μέσο όρο 100 ετών)[24]. Το μεθάνιο όμως οξειδώνεται αργά στην ατμόσφαιρα της Γης από το ατμοσφαιρικό οξυγόνο (O2), με τη βοήθεια της υγρασίας (H2O) και της υπεριώδους ακτινοβολίας (UV) του ηλιακού φωτός. Το αποτέλεσμα αυτής της οξείδωσης είναι να έχει το μεθάνιο ημιζωή επτά (7) ετών στη γήινη ατμόσφαιρα.
Το στρατοσφαιρικό μεθάνιο (δηλαδή όσο ανέρχεται στο ομώνυμο ατμοσφαιρικό στρώμα) επηρεάζει επίσης το στρατοσφαρικό στρώμα του όζοντος[25][26].
Η μοριακή αναλογία του μεθανίου στην ατμόσφαιρα της Γης το 1750 υπολογίστηκε ότι ήταν 700 ppb. Tο 1998 ανέβηκε στα 1.745 ppb. Το 2008 έφτασε τα 1.800 ppb[27]. Το 2010 μετρήθηκε στην Αρκτική στα 1850 ppb, ένα επίπεδο που αποτελεί το υψηλότερο εδώ και 400.000 χρόνια[28]. Ιστορικά, τα επίπεδα της μοριακής συγκέντρωσης μεθανίου στην ατμόσφαιρα της Γης κυμαίνονταν μεταξύ 300 και 400 ppb, κατά τις εποχές των παγετώνων και μεταξύ 600 και 700 ppb, κατά τις μεσοπαγετώδεις περιόδους.
Επιπλέον, υπάρχουν μεγάλες ποσότητες μεθανυδριτών στους ωκεάνιους πυθμένες. Ο φλοιός της Γης περιέχει τεράστιες ποσότητες μεθανίου που δημιουργήθηκε με αναερόβια μεθανογένεση. Άλλες πηγές μεθανίου περιλαμβάνουν τα ηφαίστεια, οι χωματερές και η κτηνοτροφία από την εντερική ζύμωση κυτταρινούχων τροφών.
Ονοματολογία
[επεξεργασία]Η ονομασία «μεθάνιο» προέρχεται από την ονοματολογία κατά IUPAC. Συγκεκριμένα, το πρόθεμα «μεθ-» δηλώνει την παρουσία ενός (1) ατόμου άνθρακα ανά μόριο της ένωσης, το ενδιάμεσο «-αν-» δείχνει την παρουσία μόνο απλών δεσμών μεταξύ ατόμων άνθρακα στο μόριο και η κατάληξη «-ιο» φανερώνει ότι δεν περιέχει χαρακτηριστικές ομάδες, δηλαδή ότι είναι υδρογονάνθρακας.
Πιο αναλυτικά:
Το μεθάνιο πήρε το όνομά του από τη ρίζα μεθύλιο και την κατάληξη «-ανιο» που χαρακτηρίζει τα αλκάνια (τους κορεσμένους αλειφατικούς υδρογονάνθρακες). Οι ονομασίες των ομάδων μεθυλένιο (−CH2−) και μεθύλιο (CH3−) χρησιμοποιήθηκαν για πρώτη φορά από τους Γάλλους χημικούς Ζαν-Μπαπτίστ Ντουμάς και Ευτζέν Πελιγκότ, όταν κατά τη δεκαετία 1830-1840 μελετούσαν τη μεθανόλη (CH3OH), κύριο προϊόν «ξηράς απόσταξης» ξύλου. Η μεθανόλη αρχικά αναφερόταν με το εμπειρικό όνομα «ξυλόπνευμα» (wood alcohol, pyroxylic spirit). Θέλοντας να δώσουν ένα ελληνικής προέλευσης όνομα, όπως ήταν η συνήθεια της εποχής, χρησιμοποίησαν τις λέξεις «μέθη» (από τη φυσιολογική δράση της μεθανόλης) και «ύλη» (κομμάτια ξύλου, π.χ. «υλοτομία») και τελικά ονόμασαν την αλκοόλη «μεθυλική αλκοόλη» (methyl alcohol). Από τότε η κατάληξη «-υλιο» γενικεύτηκε για τις ονομασίες όλων των οργανικών και μερικών ανόργανων ριζών[29].
Φυσική παρουσία
[επεξεργασία]Είναι αρκετά διαδεδομένο στη φύση, καθώς αποτελεί το κύριο συστατικό του φυσικού αερίου (περίπου 75%). Απαντάται επίσης σε ανθρακωρυχεία (αέριο ορυχείων) καθώς και σε περιοχές όπως έλη ή πυθμένες λιμνών, όπου γίνεται αποσύνθεση οργανικών υλών και εκλύεται υπό μορφή φυσαλίδων.
Παραγωγή
[επεξεργασία]Βιολογική παραγωγή
[επεξεργασία]Το μεθάνιο που βρήσκεται στη φύση από μη ανθρωπογενείς αιτίες παράγεται κυρίως από μια βιοχημική διεργασία που ονομάζεται «μεθανογένεση». Είναι το συνολικό αποτέλεσμα διεργασιών που χρησιμοποιούνται από μικροοργανισμούς για την παραγωγή ενέργειας απουσία οξυγόνου. Η καθαρή αντίδραση αποδίδεται στοιχειομετρικά ως εξης:
Το τελικό βήμα της διεργασίας καταλύεται από το ένζυμο μεθυλοσυνενζυμο Μ αναγωγάση. Η μεθανογενεση είναι μια μορφή αναερόβιου μεταβολισμού που χρησιμοποιείται τόσο από ελεύθερους όσο και από συμβιωτικούς μικροοργανισμούς που μεταξύ άλλων ζουν σε χωματερές, έντερα θηλαστικών και τερμιτών.
Είναι αβέβαιο αν τη χρησιμοποιούν και και κάποια φυτά[30][31][32].
Απομόνωση από φυσικές και βιομηχανικές πηγές
[επεξεργασία]Το μεθάνιο στο φυσικό αέριο
[επεξεργασία]Το φυσικό αέριο αποτελεί την κύρια πηγή απομόνωσης μεθανίου. Πρόκειται για μίγμα αερίων που βρίσκεται σε φυσικά κοιτάσματα εγκλεισμένα στο φλοιό της Γης. Συνήθως αποτελείται από μίγμα αερίων υδρογονανθράκων, κυρίως μεθανίου και αιθανίου και υδρογόνου. Μερικές φορές περιέχει επίσης ήλιο, άζωτο και υδρόθειο. Το αέριο αυτό θεωρείται γενικά ότι παράγεται με αναερόβια αποσύνθεση οργανικών υλικών υπό πίεση βαθιά κάτω από τη γήινη επιφάνεια.
Βιοαέριο
[επεξεργασία]Πέρα από τα αποθέματα φυσικού αερίου, μια εναλλακτική πηγή μεθανίου είναι το βιοαέριο. Αυτό παράγεται από την επίσης αναερόβια αποσσύνθεση οργανικών υλικών που προέρχονται από ανθρώπινα λύματα παραχωμένα σε χωματερές, από υπονόμους, βόθρους, ημιτελείς βιολογικούς καθαρισμούς και από βιοδιασπώμενα υπολείμματα ζωοτροφών.
Μια εναλλακτική πηγή βιοαερίου αποτελούν τα βουστάσια, τα χοιροστάσια και τα εκτροφεία πουλερικών: Τα ζώα αυτά αποβάλλουν αέρια ως παραπροϊόντα της πέψης τους. Ειδικά τα πρώτα θεωρείται ότι παράγουν το 16% της ετήσιας διαφυγής μεθανίου στην ατμόσφαιρα του πλανήτη μας[33]. Αν προσθέσουμε τα χοιροστάσια και τα εκτροφεία πουλερικών φτάνουμε στο 37%[34] [35][36][37]. Το υπόλοιπο προέρχεται από το αντίστοιχο αέριο που παράγουν οι άνθρωποι, το υπόλοιπο ζωικό βασίλειο, οι ορυζώνες (που επίσης μπορούν να χρησιμοποιηθούν σαν πηγή βιοαερίου και άρα μεθανίου) και διάφορες γεωλογικής προέλευσης πηγές.
Οι μεθανυδρίτες
[επεξεργασία]
Ακόμη υπάρχουν αποθέματα μεθανυδριτών (methane hydrates/clathrates), ένα είδος «διαλύματος» (δηλαδή ομογενούς μίγματος) αερίου μεθανίου σε κρυστάλλους πάγου στο οποίο μόρια μεθανίου εγκλωβίζονται στο κενό που δημιουργούν τα μόρια του νερού, κατά την πήξη του σε πάγο, στο εσωτερικό των κρυστάλλων του. Αυτά καταβυθίζονται στον πυθμένα του ωκεανού ψυχρών περιοχών ή σχηματίζονται στο παγωμένο έδαφος τούνδρας. Το μεθάνιο αυτό εγκλωβίστηκε στο μακρυνό παρελθόν, σε εποχές που η Γη είχε πάθει εκτεταμένη παγογένεση και ταυτόχρονα περιείχε ακόμη μεγάλες συγκεντρώσεις μεθανίου στην ατμόσφαιρά της. Τα αποθέματα αυτά αποτελούν μεγάλη πηγή μεθανίου, για το μέλλον, αλλά ταυτόχρονα απειλούν τον πλανήτη με επιπλέον οικολογική καταστροφή στην περίπτωση που λειώσουν και απελευθερώσουν το μεθάνιό τους εξαιτίας της υπερθέρμανσης του πλανήτη από το φαινόμενο του θερμοκηπίου.
Βιομηχανικές πηγές
[επεξεργασία]Βιομηχανικά το μεθάνιο μπορεί να παραχθεί από ατμοσφαιρικό αέρα (που περιέχει διοξείδιο του άνθρακα) και υδρογόνο μέσω ειδικών χημικών αντιδράσεων όπως οι ακόλουθες:
1. Διεργασία Sabatier:
Η διεργασία Sabatier ή αντίδραση Sabatier περιλάμβανε αρχικά την καταλυτική αναγωγή διοξειδίου του άνθρακα (CO2) από υδρογόνο (H2), παρουσία [w:[νικέλιο|νικελίου]] (Ni) στο ρόλο του καταλύτη και σε αυξημένη θερμοκρασία. Ανακαλύφθηκε από το γάλλο χημικό Πωλ Σαμπατιέρ. Αργότερα βρέθηκε ότι άλλοι καταλύτες όπως το ρουθήνιο (Ru) ή η αλουμίνα (Al2O3) είναι πιο αποτελεσματικοί γι' αυτήν την αντίδραση. Η αντίδραση περιγράφεται από την ακόλουθη στοιχειομετρική εξίσωση:
Έχει προταθεί να χρησιμοποιηθεί η παραπάνω αντίδραση για την αποθήκευση ενέργειας που προέρχεται από πλεόνασμα αυτής από σύστημα ανανεώσιμων πηγών, όπως η αιολική, η φωτοβολολταϊκή, η υδροηλεκτρική, κ.τ.λ., με την παραγωγή μεθανίου, δηλαδή συνθετικού φυσικού αερίου[38],[39].
2. Απομονώνεται από το φωταέριο.
3. Απομονώνεται από αέρια μίγματα που προκύπτουν από πυρόλυση προϊόντων διύλισης πετρελαίου ή πολυμερών υδρογονανθράκων.
Με ειδικές μεθόδους
[επεξεργασία]1. Με απευθείας ένωση άνθρακα (C) και υδρογόνο (H2) (απουσία αέρα) σε υψηλή θερμοκρασία και πίεση και παρουσία καταλυτών[29]:
2. Mε την επίδραση νερού (Η2O) σε ανθρακαργίλιο (Al4C3)[40]:
3. Με καταλυτική αναγωγή μονοξείδιου του άνθρακα (CO) από υδρογόνο (H2)[29]:
- Οι υπόλοιπες μέθοδοι αναφέρονται στην ενότητα της γενικής παραγωγής αλκανίων.
Χημικές ιδιότητες και παράγωγα
[επεξεργασία]Οξεοβασική συμπεριφορά
[επεξεργασία]Όπως και οι άλλοι υδρογονάνθρακες, το μεθάνιο είναι ένα πολύ ασθενές οξύ. Σε διμεθυλοσουλφοξείδιο εκτιμάται ότι έχει pKa = 56[41] . Δεν μπορεί να αποπρωτονιωθεί σε διάλυμα, αλλά είναι γνωστό, για παράδειγμα, το μεθυλολίθιο, που μπορεί να θεωρηθεί ως συζυγής βάση. Επίσης, μπορεί να επιτευχθεί πρωτονίωση του μεθανίου με χρήση σουπεροξέων, οπότε δίνει CH5+, που ονομάζεται «μεθανοϊόν». Παρόλη την ισχύ των δεσμών C-H, που διαθέτει είναι δυνατή η χρήση καταλυτών για την ενεργοποίησή τους[42].
- Οι υπόλοιπες μέθοδοι αναφέρονται στην ενότητα των γενικών παραγώγων των αλκανίων.
Εφαρμογές
[επεξεργασία]Το μεθάνιο χρησιμοποιήθηκε για βιομηχανικές χημικές διεργασίες και μπορεί να μεταφερθεί υγροποιημένο υπό ψύξη (συνήθως ως υγροποιημένο φυσικό αέριο, LNG). Παρόλο που τυχόν διαφυγές από υγροποιημένο μεθάνιο είναι προσωρινά βαρύτερες από τον αέρα, με τη σταδιακή εξισορρόπηση της θερμοκρασίας, το μεθάνιο γίνεται ελαφρύτερο από τον ατμοσφαιρικό αέρα. Επίσης, αγωγοί φυσικού αερίου διανέμουν μεγάλες ποσότητες φυσικού αερίου, του οποίου το μεθάνιο είναι το κύριο συστατικό.
Ως καύσιμο
[επεξεργασία]Το μεθάνιο, με τη μορφή του φυσικού αερίου, είναι σημαντικό για την παραγωγή ηλεκτρικής ενέργειας με καύση σε αεριοστρόβιλο όσο και σε λέβητα ατμοστροβίλου. Σε σύγκριση με άλλα καύσιμα υδρογονανθράκων, το μεθάνιο παράγει λιγότερο διοξείδιο του άνθρακα για κάθε μονάδα ενέργειας που αποδίδει. Περίπου 891 kJ/mol είναι η μοριακή θερμότητα τέλειας καύσης του μεθανίου, χαμηλότερη από κάθε άλλο υδρογονάνθρακα. Όμως, έχει μοριακή μάζα ~16 g/mol, από την οποία τα ~12 g/mol είναι ο άνθρακας. Αυτό δείχνει ότι το μεθάνιο αποδίδει 55,7 kJ/g, δηλαδή πολύ περισσότερη από κάθε άλλο υδρογονάνθρακα. Σε πολλές πόλεις παγκοσμίως χρησιμοποιείται φυσικό αέριο (δηλαδή κυρίως μεθάνιο) στα σπίτια για θέρμανση και μαγείρευμα, με μέση ενεργειακή απόδοση ~39 MJ/m3 ή ~1.000 BTU/ft3.
Ακόμη, το μεθάνιο, με τη μορφή συμπιεσμένου φυσικού αερίου, χρησιμοποιήθηκε ως καύσιμο οχημάτων και θεωρήθηκε ως περιβαντολλογικά φιλικότερο από άλλα ορυκτά καύσιμα, όπως η βενζίνη και το ντήζελ[43]. Η έρευνα σε μεθόδους προσρόφησης για την αποθήκευση μεθανίου για το σκοπό αυτό συνεχίζεται[44].
Ερευνα γίνεται από τη NASA για τη χρήση μεθανίου ως εν δυνάμει καύσιμο για πυραύλους[45].
Το μεθάνιο που εκλύεται από ανθακωρυχεία μετατρέπεται σε ηλεκτρική ενέργεια[46].
Ως χημική πρώτη ύλη
[επεξεργασία]Έχει χρησιμοποιηθεί κατά καιρούς ως πρώτη ύλη των ακολούθων παραγώγων:
- Υδραέριο (CO + H2)
- Μεθανόλη (CH3OH)
- Νιτρομεθάνιο (CH3NO2)
- Αλομεθάνια (CH4-xXx, όπου X: αλογόνα και x : 1-4)
- Μεθανάλη (HCHO)
- Αιθίνιο (ΗC≡CH)
- Αιθένιο [CH2=CH2)
- Αιθάνιο (CH3CH3)
Υδραέριο
[επεξεργασία]Παρόλο που υπάρχει μεγάλο ενδιαφέρον μετατροπής του μεθανίου σε πιο χρήμιες ή τουλάχιστον πιο εύκολα υγροποιήσιμες, η μόνη υπάρχουσα πρακτική διεργασία είναι σχετικά ανεπιθύμητη: Στη χημική βιομηχανία το μεθάνιο με επίδραση υδρατμών μετατρέπεται σε υδραέριο, ένα μίγμα μονοξειδίου του άνθρακα και υδρογόνου. Πρόκειται όμως για μια ενεργοβόρα διεργασια που χρησιμοποιεί νικέλιο ως καταλύτη και απαιτεί υψηλές θερμοκραίες, γύρω στους 700–1100 °C:
Αμμωνία
[επεξεργασία]Ανάλογες χημικές διεργασίες ερευνήθηκαν και αξιοποιήθηκαν στην σύνθεση αμμωνίας Haber-Bosch, στην οποία το μεθάνιο (προερχόμενο από το φυσικό αέριο) αντιδρά με το άζωτο και το οξυγόνο του ατμοσφαιρικού αέρα σχηματίζοντας διοξείδιο του άνθρακα, νερό και αμμωνία. Συνολικά, με πρόσθεση κατά μέρη των στοιχειομετρικών εξισώσεων:
Αλομεθάνια
[επεξεργασία]Το μεθάνιο μπορεί ακόμη να υποστεί αλογόνωση (συνήθως χλωρίωση) με το μηχανισμό των ελευθέρων ριζών, για την παραγωγή αλομεθανίων (συνήθως χλωρομεθανίου, διχλωρομεθάνιου, τριχλωρομεθανίου και τετραχλωράνθρακα, αν και για την παραγωγή του πρώτου χρησιμοποιείται περισσότερο η μεθανόλη, ως πρώτη ύλη)[47].
Επίδραση στην ανθρώπινη υγεία
[επεξεργασία]Το ίδιο το μεθάνιο δεν είναι τοξικό. Είναι όμως εξαιρετικά εύφλεκτο και μπορεί να προκαλέσει έκρηξη σε μίγματά του με τον αέρα. Επίσης το μεθάνιο αντιδρά βίαια με οξειδωτικές ουσίες, στις οποίες περιλαμβάνονται τα αλογόνα και μερικές αλογονούχες ενώσεις. Επίσης είναι δυνατό να προκαλέσει ασφυξία, γιατί απλά μπορεί να μειώσει τη συγκέντρωση του οξυγόνου σε κλειστούς χώρους. Κάτι τέτοιο είναι πιθανό να συμβεί από διαρροή φυσικού αερίου ή φωταερίου αλλά και διείσδυση βιαερίου από κοντινές χωματερές.
Παρατηρήσεις, υποσημειώσεις και αναφορές
[επεξεργασία]- ↑ Δεν χρησιμοποιείται ο κανόνας όταν εννοούνται οι αριθμοί θεσης, δηλαδή όταν υπάρχει μια μοναδική κατανομή των διακλαδώσεων στη συγκεκριμένη κύρια ανθρακική αλυσίδα.
- ↑ όπου με Χ συμβολίζεται ένα αλογόνο και με R ένα αλκύλιο.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 152, §6.2.2
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ.42, §4.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 152, §6.2.4α
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 152, §6.2.3β
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ. 155, §6.7.3
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», Παρατηρητής, Θεσσαλονίκη 1991, Σελ. 14, §1.1.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- ↑ SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999, Σελ. 42, §4.3.
- ↑ Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991, σελ. 291-293, §19.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.6β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.7.6α, R = R' = CH3
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.269, §11.6B7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ.269, §11.6B7.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 155, §6.7.3.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 244 , §10.3.2
- ↑ Η χαρακτηριστική οσμή του φυσικού αερίου και του φωτοαερίου δεν προέρχεται από το μεθάνιο, αλλά από πρόσθετες οσμηρές ουσίες (συνήθως μεθανοθειόλη) που συχνά προστίθενται τεχνητά στο φυσικό αέριο για να ανιχνεύεται πιο εύκολα σε ανεπιθύμητες διαρροές.
- ↑ Διαχωρίζεται όμως το υδρογόνο, που είναι επίσης συστατικό του φυσικού αερίου, αλλά έχει κρίσιμη θερμοκρασία -240 °C.
- ↑ IPCC Fourth Assessment Report.
- ↑ Ozon – wpływ na życie człowieka, Ozonowanie/Ewa Sroka, Group: Freony i inne związki, Reakcje rozkładu ozonu.
- ↑ Twenty Questions And Answers About The Ozone Layer, UNEP/D.W. Fahey 2002, pp. 12, 34, 38
- ↑ http://www.noaanews.noaa.gov/stories2008/20080423_methane.html Carbon Dioxide, Methane Rise Sharply in 2007]
- ↑ Methane seen as growing climate risk
- ↑ 29,0 29,1 29,2 ΕΚΠΑ-Τμήμα Χημείας: Η χημική ένωση του μήνα: Μεθάνιο, Βαλαβανίδης-Ευσταθίου, Ιούλιος 2008
- ↑ Hamilton JT, McRoberts WC, Keppler F, Kalin RM, Harper DB (July 2003). "Chloride methylation by plant pectin: an efficient environmentally significant process". Science 301 (5630): 206–9. DOI:10.1126/science.1085036.
- ↑ "Methane Emissions? Don't Blame Plants", ScienceNOW, 14 January 2009
- ↑ Plants do emit methane after all. New Scientist (2 December 2007).
- ↑ Miller, G. Tyler. Sustaining the Earth: An Integrated Approach. U.S.A.: Thomson Advantage Books, 2007. 160.
- ↑ Livestock’s Long Shadow–Environmental Issues and Options. Retrieved on 2009-10-27.
- ↑ California Cows Fail Latest Emissions Test
- ↑ New Zealand Tries to Cap Gaseous Sheep Burps
- ↑ Research on use of bacteria from the stomach lining of kangaroos (who don't emit methane) to reduce methane in cattle
- ↑ Bioenergy and renewable power methane in integrated 100% renewable energy system, [1],
- ↑ scénario négaWatt 2011 (France), [2],
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, σελ. 152, §6.2.4β.
- ↑ Equilibrium acidities in dimethyl sulfoxide solution Frederick G. Bordwell Acc. Chem. Res.; 1988; 21(12) pp 456 – 463; Πρότυπο:DOI
- ↑ Wesley H. Bernskoetter, Cynthia K. Schauer, Karen I. Goldberg and Maurice Brookhart "Characterization of a Rhodium(I) σ-Methane Complex in Solution" Science 2009, Vol. 326, pp. 553–556. Πρότυπο:DOI
- ↑ Clayton B. Cornell (April 29, 2008). Natural Gas Cars: CNG Fuel Almost Free in Some Parts of the Country. http://www.gas2.org/2008/04/29/natural-gas-cars-cng-fuel-almost-free-in-some-parts-of-the-country/. "Compressed natural gas is touted as the 'cleanest burning' alternative fuel available, since the simplicity of the methane molecule reduces tailpipe emissions of different pollutants by 35 to 97%. Not quite as dramatic is the reduction in net greenhouse-gas emissions, which is about the same as corn-grain ethanol at about a 20% reduction over gasoline"
- ↑ (2004). "Design of New Materials for Methane Storage". Langmuir 20 (7): 2683–9. DOI:10.1021/la0355500.
- ↑ Lunar Engines, Aviation Week & Space Technology, 171, 2 (13 July 2009), p. 16: "Aerojet has completed assembly of a 5,500-pound-thrust liquid oxygen/liquid methane rocket engine—a propulsion technology under consideration as the way off the Moon for human explorers" One advantage of methane is that it is abundant in many parts of the solar system and it could potentially be harvested in situ (i.e. on the surface of another solar-system body), providing fuel for a return journey.Methane Blast, NASA, May 4, 2007. Current methane engines in development produce a thrust of Πρότυπο:Convert, which is far from the Πρότυπο:Convert needed to launch the Space Shuttle. Instead, such engines will most likely propel voyages from the Moon or send robotic expeditions to other planets in the solar system.Green, V. (September). "Hit the Gas: NASA's methane rocket could make long distance space travel possible, on the cheap" 271 (3): 16–17.
- ↑ A Global First: Coal Mine Turns Greenhouse Gas into Green Energy
- ↑ M. Rossberg et al. “Chlorinated Hydrocarbons” in Ullmann’s Encyclopedia of Industrial Chemistry 2006, Wiley-VCH, Weinheim. Πρότυπο:DOI





![{\displaystyle \mathrm {RX+2Li{\xrightarrow[{-10^{o}C,-LiX}]{|Et_{2}O|}}RLi{\xrightarrow[{CuX}]{+R{\acute {}}X}}RR{\acute {}}+LiX} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1957e3db7d3287c32cd3cbac161c2c9f66544661)

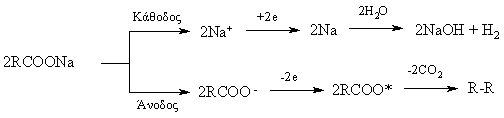
![{\displaystyle \mathrm {RH+[:CH_{2}]{\xrightarrow {}}RCH_{3}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/d6ad34daa15c1e37b9eea2ad08f890ebe56a3e21)

















![{\displaystyle \mathrm {CH_{4}+O_{2}{\xrightarrow[{\triangle }]{Cu}}HCHO+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/ebfb41bb8b818e5bc8374f5f0ad0e5fac101adb8)
![{\displaystyle \mathrm {X_{2}{\xrightarrow[{\triangle }]{UV}}X^{\bullet }} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/66146d1fe627d440f33ce94d51cc15325163dcb3)





![{\displaystyle \mathrm {RH+HNO_{3}{\xrightarrow[{{\acute {\eta }}\;140^{o}C,\;\pi {\acute {\iota }}\epsilon \sigma \eta }]{\alpha {\acute {\epsilon }}\rho \iota \alpha \;\phi {\acute {\alpha }}\sigma \eta }}RNO_{2}+H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1d59c4bbb68a1aa337a7e3f053ba6fbf96f86470)



![{\displaystyle \mathrm {CO_{2}+4H_{2}{\xrightarrow[{Ni\;{\acute {\eta }}\;Ru\;{\acute {\eta }}\;Al_{2}O_{3}}]{\triangle }}CH_{4}+2H_{2}O} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9fed185a3161a1b0f2a466932a456e0ec389529a)



![{\displaystyle \mathrm {CH_{4}+H_{2}O{\xrightarrow[{700-1100^{o}C}]{Ni}}CO+3H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/8f90bbb2a4bfb92ca0b3589f127748e06d9e5b12)
